Lý thuyết Hóa học lớp 10 Bài 3: Nguyên tố hóa học
A. Lý thuyết Nguyên tố hóa học
I. Hạt nhân nguyên tử
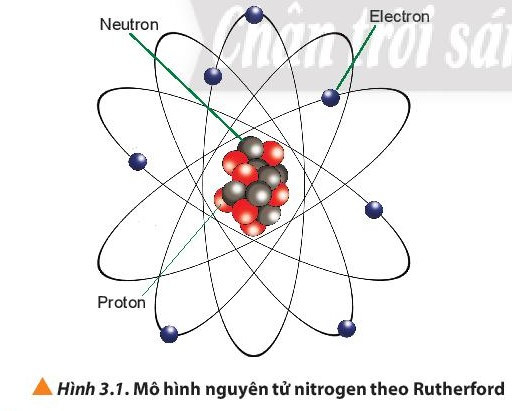
– Số đơn vị điện tích hạt nhân (Z) = số proton (P) = số electron (E).
– Điện tích hạt nhân = + Z.
– Số khối (A) = số proton (P) + số neutron (N)
Ví dụ: Nguyên tử aluminium (Al) có 13 proton, 14 neutron. Suy ra:
+ Nguyên tử aluminium có số đơn vị điện tích hạt nhân = số proton = số electron = 13.
+ Điện tích hạt nhân nguyên tử aluminium là +13.
+ Số khối A = số proton (P) + số neutron (N) = 13 + 14 = 27.
II. Nguyên tố hóa học
1. Số hiệu nguyên tử
– Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố được gọi là số hiệu nguyên tử (Z) của nguyên tố đó.
– Mỗi nguyên tố hóa học có một số hiệu nguyên tử.
– Số hiệu nguyên tử (kí hiệu là Z) cho biết:
+ Số proton trong hạt nhân nguyên tử.
+ Số electron trong nguyên tử.
Ví dụ: Nguyên tố carbon có số hiệu nguyên tử là 6. Suy ra:
+ Số proton trong hạt nhân nguyên tử carbon = 6
+ Số electron trong nguyên tử carbon = 6
2. Nguyên tố hóa học
– Nguyên tố hóa học là tập hợp những nguyên tử có cùng điện tích hạt nhân.
Ví dụ: Protium; deuterium và tritium là các loại nguyên tử của nguyên tố hydrogen.
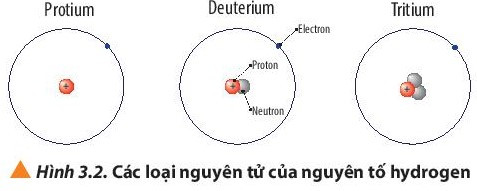
3. Kí hiệu nguyên tử
– Số đơn vị điện tích hạt nhân nguyên tử (số hiệu nguyên tử) của một nguyên tố hóa học và số khối được xem là những đặc trưng cơ bản của nguyên tử.
– Để kí hiệu nguyên tử, người ta thường ghi các chỉ số đặc trưng ở bên trái kí hiệu nguyên tố với số khối A ở phía trên, số hiệu nguyên tử Z ở phía dưới.

Ví dụ:

III. Đồng vị
– Các đồng vị của một nguyên tố hóa học là những nguyên tử có cùng số proton (P), cùng số hiệu nguyên tử (Z), nhưng khác nhau về số neutron (N). Do đó, số khối (A) của chúng khác nhau.
– Ví dụ: Potassium (K) có 3 đồng vị là:
– Trong tự nhiên, hầu hết các nguyên tố được tìm thấy dưới dạng hỗn hợp của các đồng vị.
– Ngoài các đồng vị bền, các nguyên tố hóa học còn có một số đồng vị không bền, gọi là các đồng vị phóng xạ, được sử dụng nhiều trong đời sống, y học, nghiên cứu khoa học…
IV. Nguyên tử khối và nguyên tử khối trung bình
1. Nguyên tử khối
– Nguyên tử khối là khối lượng tương đối của nguyên tử.
– Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử (1 amu).
– Một cách gần đúng, coi nguyên tử khối có giá trị bằng số khối.
Ví dụ: Nguyên tử của nguyên tố magnesium (Mg) có 12 proton và 12 neutron.
⇒ Nguyên tử khối của Mg = 12 + 12 = 24 amu
2. Nguyên tử khối trung bình
– Mỗi nguyên tố thường có nhiều đồng vị, do đó trong thực tế người ta thường sử dụng giá trị nguyên tử khối trung bình.
– Muốn xác định giá trị nguyên tử khối trung bình của một nguyên tố, ta cần phải biết được phần trăm số nguyên tử các đồng vị của nguyên tố đó trong tự nhiên. Người ta thường dùng phương pháp phổ khối lượng để xác định phần trăm số nguyên tử các đồng vị tự nhiên của các nguyên tố.
– Công thức tính nguyên tử khối trung bình của nguyên tố X:
Trong đó:
: là nguyên tử khối trung bình của X
Ai: là nguyên tử khối đồng vị thứ i
ai: là tỉ lệ % số nguyên tử đồng vị thứ i
Ví dụ:
Trong tự nhiên, nguyên tố copper có hai đồng vị với phần trăm số nguyên tử tương ứng là (69,15%) và (30,85%). Nguyên tử khối trung bình của nguyên tố copper là:
B. Trắc nghiệm Nguyên tố hóa học
Câu 1. Số hiệu nguyên tử của một nguyên tố là
A. điện tích hạt nhân nguyên tử của nguyên tố đó
B. số đơn vị điện tích hạt nhân nguyên tử của nguyên tố đó
C. tổng số proton và neutron trong nguyên tử của nguyên tố đó
D. tổng số proton và electron trong nguyên tử của nguyên tố đó
Hướng dẫn giải
Đáp án đúng là: B
Số hiệu nguyên tử của một nguyên tố (Z) là số đơn vị điện tích hạt nhân nguyên tử của nguyên tố đó.
Câu 2. Nguyên tố hóa học là
A. tập hợp các nguyên tử có cùng số hạt neutron;
B. tập hợp các nguyên tử có cùng điện tích hạt nhân;
C. tập hợp các nguyên tử có cùng số hạt neutron và proton;
D. tập hợp các nguyên tử có cùng số số khối A.
Hướng dẫn giải
Đáp án đúng là: B
Nguyên tố hóa học là tập hợp các nguyên tử có cùng điện tích hạt nhân.
Câu 3. Kí hiệu nguyên tử cho biết
A. kí hiệu hóa học của nguyên tố (X);
B. số hiệu nguyên tử (Z);
C. số khối (A);
D. Cả A, B và C đều đúng.
Hướng dẫn giải
Đáp án đúng là: D
Kí hiệu nguyên tử cho biết kí hiệu hóa học của nguyên tố (X); số hiệu nguyên tử (Z); số khối (A).
Câu 4. Một nguyên tử sodium (Na) có 11 electron; 11 proton và 12 neutron. Kí hiệu của nguyên tử này là
A.
B.
C.
D.
Hướng dẫn giải
Đáp án đúng là: C
Một nguyên tử sodium (Na) có:
– Số hiệu nguyên tử Z = số đơn vị điện tích hạt nhân = số p = 11
– Số khối A = P + N = số p + số n = 11 + 12 = 23
Kí hiệu nguyên tử là .
Câu 5. Cho kí hiệu nguyên tử . Khẳng định nào sau đây sai?
A. Kí hiệu hóa học của nguyên tố là O;
B. Số hiệu nguyên tử là 8;
C. Số proton trong một hạt nhân nguyên tử là 8;
D. Số neutron trong một hạt nhân nguyên tử là 8.
Hướng dẫn giải
Đáp án đúng là: B
Kí hiệu nguyên tử cho biết:
– Kí hiệu hóa học của nguyên tố là O;
– Số hiệu nguyên tử Z = 8 ⇒ số proton (P) là 8.
– Số khối A = 17 mà A = P + N ⇒ N = A – P = 17 – 8 = 9 ⇒ số neutron là 9.
Vậy khẳng định: Số neutron trong một hạt nhân nguyên tử là 8 là khẳng định sai.
Câu 6. Khẳng định đúng là
A. Số đơn vị điện tích hạt nhân (Z) = số proton (P) = số electron (E)
B. Số đơn vị điện tích hạt nhân (+Z) = số proton (P) = số electron (E)
C. Số đơn vị điện tích hạt nhân (Z) = số proton (P) = số neutron (N)
D. Số đơn vị điện tích hạt nhân (Z) = số neutron (N) = số electron (E)
Hướng dẫn giải
Đáp án đúng là: A
Số đơn vị điện tích hạt nhân (Z) = số proton (P) = số electron (E).
Điện tích hạt nhân = + Z.
Câu 7. Nguyên tử nitơ (nitrogen) có 7 proton. Số đơn vị điện tích hạt nhân của nguyên tử này là
A. + 7
B. 7
C. + 14
D. 14
Hướng dẫn giải
Đáp án đúng là: B
Số đơn vị điện tích hạt nhân (Z) = số proton (P) = 7.
Câu 8. Nguyên tử aluminium có 13 electron. Điện tích hạt nhân của nguyên tử này là
A. 13
B. 27
C. + 13
D. + 27
Hướng dẫn giải
Đáp án đúng là: C
Số đơn vị điện tích hạt nhân (Z) = số electron (E) = 13.
Điện tích hạt nhân = + Z = + 13.
Câu 9. Công thức tính số khối (A) là
A. Số khối (A) = số proton (P) + số electron (E)
B. Số khối (A) = số neutron (N) + số electron (E)
C. Số khối (A) = số proton (P) × 2
D. Số khối (A) = số proton (P) + số neutron (N)
Hướng dẫn giải
Đáp án đúng là: D
Số khối (A) = số proton (P) + số neutron (N).
Câu 10. Nguyên tử potassium (K) có 19 electron; 19 proton và 20 neutron. Số khối nguyên tử của K là
A. 20
B. 19
C. 39
D. 58
Hướng dẫn giải
Đáp án đúng là: C
Số khối A = số proton + số neutron = 19 + 20 = 39.
Câu 11. Cho nguyên tử iron (Fe) có kí hiệu nguyên tử là . Số hạt electron, proton, neutron trong một nguyên tử này lần lượt là
A. 26; 26; 56
B. 26; 26; 30
C. 30; 30; 26
D. 30; 26; 26
Hướng dẫn giải
Đáp án đúng là: B
Kí hiệu nguyên tử là
Ta có: số e = số p = Z = 26
Số n = N = A – P = 56 – 26 = 30
Vậy số e, p, n lần lượt là: 26; 26; 30
Câu 12. Tổng số hạt trong nguyên tử nguyên tố X là 82. Trong hạt nhân, số hạt mang điện ít hơn số hạt không mang điện là 4. Kí hiệu nguyên tử X là:
(Cho số hiệu nguyên tử của Cr = 24; Mn = 25; Fe = 26; Zn = 30)
A.
B.
C.
D.
Hướng dẫn giải
Đáp án đúng là: B
Gọi số hạt proton, neutron, electron trong một nguyên tử X lần lượt là P, N, E.
Ta có: P = E
Tổng số hạt trong nguyên tử X là: P + N + E = 2P + N = 82 (1)
Số hạt mang điện trong hạt nhân nguyên tử là: P
Số hạt không mang điện trong hạt nhân nguyên tử là: N
Trong hạt nhân, số hạt mang điện ít hơn số hạt không mang điện là 4 nên N – P = 4 (2)
Từ (1) và (2) ta có hệ phương trình:
Giải hệ phương trình ta được P = 26; N = 30
Vì số hiệu nguyên tử Z = số p ⇒ Z = 26
⇒ X có kí hiệu hóa học là Fe.
Số khối: A = P + N = 26 + 30 = 56
Kí hiệu nguyên tử của X là
Câu 13. Nguyên tố bromine có 2 đồng vị chiếm 49,5% về số lượng nguyên tử, còn lại là
. Nguyên tử khối trung bình của bromine là:
A. 79,5;
B. 79,1;
C. 80,01;
D. 35.
Hướng dẫn giải
Đáp án đúng là: C
Thành phần phần trăm về số lượng nguyên tử của đồng vị là:
100% − 49,5% = 50,5%
Nguyên tử khối trung bình của bromine là:
Câu 14. Lithium có 2 đồng vị là 7Li và 6Li. Nguyên tử khối trung bình của Li là 6,93. Phần trăm số nguyên tử của đồng vị 7Li là:
A. 93%;
B. 7%;
C. 78%;
D. 22%.
Hướng dẫn giải
Đáp án đúng là: A
Gọi phần trăm số nguyên tử của đồng vị 7Li là x%
⇒ phần trăm số nguyên tử của đồng vị 6Li là (100 − x)%
Ta có: ⇒ x = 93
Phần trăm số nguyên tử của đồng vị 7Li là 93%.
Câu 15. Nguyên tử của nguyên tố magnesium (Mg) có 12 proton và 12 neutron. Nguyên tử khối của Mg là
A. 12 amu
B. 24 amu
C. 36 amu
D. 6 amu
Hướng dẫn giải
Đáp án đúng là: B
Do khối lượng của các electron rất nhỏ không đáng kể nên có thể coi nguyên tử khối có giá trị bằng số khối.
Do đó, nguyên tử khối của Mg = AMg = P + N = 12 + 12 = 24 (amu).
Bài giảng Hóa học 10 Bài 3: Nguyên tố hóa học – Chân trời sáng tạo
Xem thêm các bài tóm tắt lý thuyết Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 2: Thành phần của nguyên tử
Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Bài 6: Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số tính chất của hợp chất trong chu kì và nhóm