Giải bài tập Hóa học lớp 10 Bài 2: Thành phần của nguyên tử
Giải hóa học 10 trang 11 Cánh diều
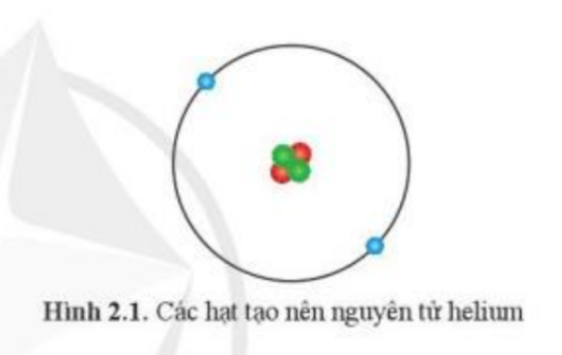
Mở đầu trang 11 Hóa học 10: Nguyên tử helium được tạo nên từ 3 loại hạt cơ bản (được tô màu khác nhau như ở Hình 2.1). Hãy gọi tên và nêu vị trí của mỗi loại hạt này trong nguyên tử.
Phương pháp giải:
– Nguyên tử được chia làm 2 phần chính:
+ Hạt nhân
+ Lớp vỏ
Lời giải:
– 3 loại hạt cơ bản tạo nên nguyên tử là:
+ Hạt proton: nằm ở hạt nhân (bên trong) của nguyên tử
+ Hạt neutron: nằm ở hạt nhân (bên trong) của nguyên tử
+ Hạt electron: nằm ở lớp vỏ (bên ngoài) của nguyên tử
I. Thành phần và cấu trúc của nguyển tử
Câu hỏi 1 trang 11 Hóa học 10: Các nguyên tử đều trung hòa về điện. Em hãy lập luận để chứng minh rằng: trong một nguyên tử, số proton và số electron luôn bằng nhau.
Phương pháp giải:
Dựa vào điện tích của các hạt trong bảng 2.1:

– Các nguyên tử trung hòa về điện => Tổng điện tích các hạt trong 1 nguyên tử = 0
Lời giải:
– Trong 1 nguyên tử, gọi:
+ Số proton là a
+ Số neutron là b
+ Số electron là c
– Vì các nguyên tử trung hòa về điện => Tổng điện tích các hạt trong 1 nguyên tử = 0.
– Ta có:
(+1).a + (-1).b + 0.c = 0
=> a – b = 0
=> a = b
Như vậy: trong một nguyên tử, số proton và số electron luôn bằng nhau.
Giải hóa học 10 trang 12 Cánh diều
Luyện tập 1 trang 12 Hóa học 10: Hạt proton, neutron nặng hơn hạt electron bao nhiêu lần?
Phương pháp giải:
Dựa vào khối lượng của các hạt trong bảng 2.1: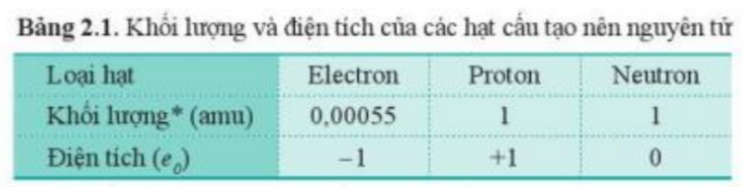
Lời giải:
Ta có:
+ Khối lượng electron = 0,00055 amu
+ Khối lượng proton = 1 amu
+ Khối lượng neutron = 1 amu
Hạt proton nặng hơn hạt electron số lần
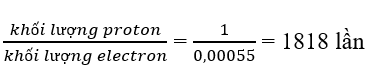
Hạt neutron nặng hơn hạt electron số lần
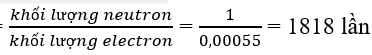
Luyện tập 2 trang 12 Hóa học 10: Hãy cho biết bao nhiêu hạt proton thì có tổng khối lượng bằng 1 gam.
Phương pháp giải:
Bước 1: Đổi 1 amu = 1,6605.10-27 kg = 1,6605.10-24 g
Bước 2: 1 proton có khối lượng là 1 amu tương ứng với 1,6605.10-24 gam
Vậy x proton có khối lượng là x amu tương ứng với 1 gam
Bước 3: Tìm giá trị của x
Lời giải:
Đổi 1 amu = 1,6605.10-27 kg = 1,6605.10-24 g
Ta có: 1 hạt proton có khối lượng là 1 amu tương ứng với 1,6605.10-24 gam
Vậy x hạt proton có khối lượng là x amu tương ứng với 1 gam
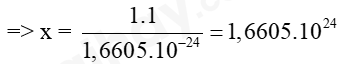
Vậy cần 1,6605.1024 hạt proton thì có tổng khối lượng bằng 1 gam.
Luyện tập 3 trang 12 Hóa học 10: Khi các nguyên tử tiến lại gần nhau để hình thành liên kết hóa học, sự tiếp xúc đầu tiên giữa hai nguyên tử sẽ xảy ra giữa
A. lớp vỏ với lớp vỏ
B. lớp vỏ với hạt nhân
C. hạt nhân với hạt nhân
Phương pháp giải:
Nguyên tử gồm lớp vỏ tạo nên bởi các hạt electron và hạt nhân tạo nên bởi các hạt proton và neutron
Lời giải:
Đang cập nhật
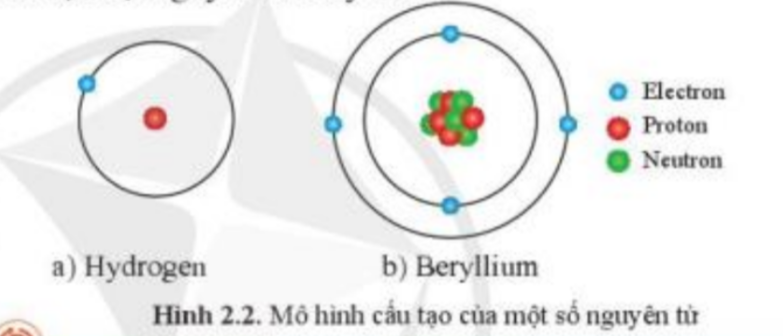
Câu hỏi 2 trang 12 Hóa học 10: Quan sát Hình 2.2, hãy chỉ ra những sự khác nhau về thành phần nguyên tử giữa nguyên tử hydrogen và beryllium
Phương pháp giải:
– Quan sát Hình 2.2: so sánh sự có mặt của các hạt electron, proton và neutron
Lời giải:
– Trong hình 2.2:
+ Nguyên tử hydrogen gồm: electron và proton
+ Nguyên tử beryllium gồm: electron, proton và neutron
=> Nguyên tử hydrogen không có hạt neutron, còn nguyên tử beryllium có hạt neutron
II. Khối lượng và kích thước của nguyên tử
Luyện tập 4 trang 12 Hóa học 10: Nguyên tử lithium (Li) tạo nên bởi 3p, 4n và 3e. Khối lượng lớp vỏ của Li bằng khoảng bao nhiêu phần trăm khối lượng của cả nguyên tử Li.
Phương pháp giải:
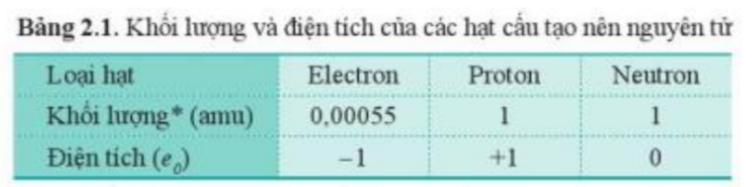
Bước 1: Dựa vào khối lượng của các hạt trong bảng 2.1:
Bước 2: Áp dụng công thức:
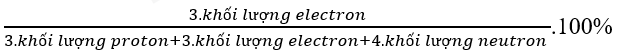
Lời giải:
– Ta có:
+ Khối lượng 1 electron = 0,00055 amu
+ Khối lượng 1 proton = 1 amu
+ Khối lượng 1 neutron = 1 amu
– Nguyên tử Li được tạo bởi: 3p, 4n và 3e
Vậy khối lượng lớp vỏ của Li chiếm phần trăm khối lượng nguyên tử Li:

Giải hóa học 10 trang 13 Cánh diều
Luyện tập 5 trang 13 Hóa học 10: Hồng cầu được coi như có dạng đĩa tròn với đường kính 7,8μm. Hỏi cần bao nhiêu nguyên tử Fr sắp xếp thẳng hàng và khít nhau để tạo nên một đoạn thẳng có chiều dài bằng đường kính của hồng cầu?
Phương pháp giải:
Fr có đường kính = 5,4
Bước 1: Đổi 7,8 μm = ? m; 5,4 = ? m
Bước 2: Tính số nguyên tử Fr để tạo nên 1 đoạn thẳng có chiều dài bằng đường kính hồng cầu
Áp dụng công thức:
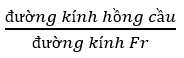
Lời giải:
Ta có: Nguyên tử Fr có đường kính = 5,4
Đổi: 7,8 μm = 7,8.10-6 m
5,4 = 5,4.10-10 m
Số nguyên tử Fr để tạo nên 1 đoạn thẳng có chiều dài bằng đường kính hồng cầu là
(nguyên tử)
Vậy cần 14444 nguyên tử Fr để tạo nên 1 đoạn thẳng có chiều dài bằng đường kính hồng cầu
Vận dụng trang 13 Hóa học 10: JJ. Thomson (J.J. Tôm – xơn), nhà vật lí người Anh, nhận giải thưởng Nô – ben vật lí vào năm 1906 vì đã phát hiện ra một loại hạt cơ bản tạo nên nguyên tử. Thomson đã chế tạo ống tia âm cực gồm một ống thủy tinh được hút phần lớn không khí ra khỏi ống, một hiệu điện thế cao được đặt vào 2 điện cực gắn ở hai đầu ống (Hình 2.4a). Ông phát hiện ra một dòng hạt (tia) đi ra từ điện cực tích điện âm (cực âm) sang điện cực tích điện dương (cực dương). Tia này được gọi là tia âm cực.

Các hạt tạo nên tia âm cực có các đặc điểm: (1) Chuyển động theo đường thẳng trong ống (Hình 2.4a). (2) Hoàn toàn giống nhau dù các vật liệu làm cực âm khác nhau. (3) Bị lệch trong điện trường, về phía bản cực tích điện dương được đặt giữa ống tia âm cực (Hình 2.4b).
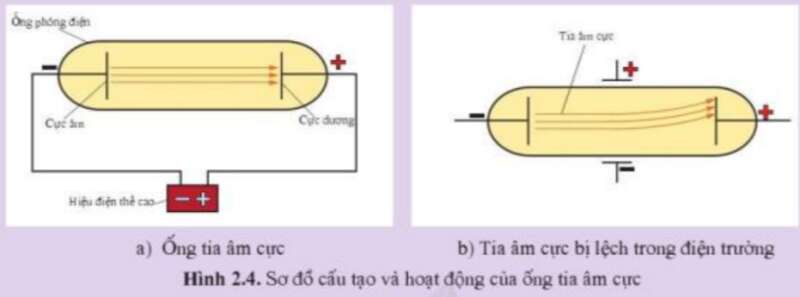 Hãy cho biết hạt tạo nên tia âm cực là loại hạt gì. Giải thích
Hãy cho biết hạt tạo nên tia âm cực là loại hạt gì. Giải thích
Phương pháp giải:
– Một nguyên tử bao gồm các hạt:
+ Electron: mang điện tích âm
+ Proton: mang điện tích dương
+ Neutron: không mang điện
– Từ dữ liệu (3) => Tia âm cực là chùm hạt mang điện tích gì?
Lời giải:
– Một nguyên tử bao gồm các hạt:
+ Electron: mang điện tích âm
+ Proton: mang điện tích dương
+ Neutron: không mang điện
– Tia âm cực bị lệch trong điện trường, về phía bản cực tích điện dương được đặt giữa ống tia âm cực
=> Chứng tỏ tia âm cực là chùm hạt mang điện tích âm
=> Hạt tạo nên tia âm cực là hạt electron.
Giải hóa học 10 trang 15 Cánh diều
Bài tập (trang 15)
Bài 1 trang 15 Hóa học 10: Một loại nguyên tử hydrogen có cấu tạo đơn giản nhất, chỉ tạo nên từ 1 electron và 1 proton. Những phát biểu nào sau đây là đúng khi nói về nguyên tử hydrogen?
(a) Đây là nguyên tử nhẹ nhất trong số các nguyên tử được biết cho đến nay
(b) Khối lượng nguyên tử xấp xỉ 2 amu
(c) Hạt nhân nguyên tử có khối lượng lớn gấp khoảng 1818 lần khối lượng lớp vỏ.
(d) Kích thước của nguyên tử bằng kích thước của hạt nhân.
Phương pháp giải:
(a). Khối lượng nguyên tử = 0,00055. số electron + 1. số proton + 1. số neutron
(b). Khối lượng nguyên tử = 0,00055. số electron + 1. số proton + 1. số neutron
(c). Áp dụng công thức:
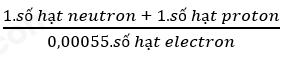
(d). Kích thước của hạt nhân rất nhỏ so với kích thước của nguyên tử
Lời giải:
(a). Khối lượng nguyên tử hydrogen = 0,00055. 1 + 1. 1 + 1. 0 ≈ 1 => Đây là nguyên tử nhẹ nhất được biết cho đến nay => Đúng
(b). Khối lượng nguyên tử hydrogen = 0,00055. 1 + 1. 1 + 1. 0 ≈ 1amu => Sai
(c). ![]()
(d). Kích thước của hạt nhân rất nhỏ so với kích thước của nguyên tử => Sai
Vậy những ý kiến đúng là (a) và (c)
Bài 2 trang 15 Hóa học 10: Các đám mây gây hiện tượng sấm sét tạo nên bởi những hạt nước nhỏ li ti mang điện tích. Một phép đo thực nghiệm cho thấy, một giọt nước có đường kính 50 , mang một lượng điện tích âm là -3,33 x 10-17 C. Hãy cho biết điện tích âm của giọt nước trên tương đương với điện tích của bao nhiêu electron.
Phương pháp giải:
– Một electron có điện tích = -1 x 1,602 x 10-19C = -1,602 x 10-19C
– Áp dụng công thức:

Lời giải:
1e có điện tích = -1 x 1,602 x 10-19C = -1,602 x 10-19C
Điện tích âm của giọt nước trên tương đương với điện tích số electron là:
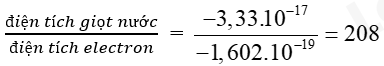
Bài 3 trang 15 Hóa học 10: Nguyên tử không mang điện vì
A. được tạo nên bởi các hạt không mang điện.
B. có tổng số hạt proton bằng tổng số hạt electron.
C. có tổng số hạt electron bằng tổng số hạt neutron.
D. tổng số hạt neutron bằng tổng số hạt proton.
Phương pháp giải:
Trong nguyên tử, số proton luôn bằng số electron.
Lời giải:
– Một nguyên tử trung hòa về điện bao gồm:
+ Electron mang điện tích -1
+ Proton mang điện tích +1
+ Neutron không mang điện
– Ta có: số hạt proton = số hạt electron = a
=> (-1).a + (+1).a = 0
=> Nguyên tử không mang điện vì có tổng số hạt proton bằng tổng số hạt electron.
Đáp án B
Bài 4 trang 15 Hóa học 10: Trả lời các câu hỏi sau:
a) Loại hạt nào được tìm thấy trong hạt nhân nguyên tử?
b) Loại hạt nào được tìm thấy ở lớp vỏ nguyên tử?
c) Loại hạt nào mang điện trong nguyên tử?
d) Kích thước nguyên tử lớn hơn kích thước hạt nhân nguyên tử khoảng bao nhiêu lần?
Phương pháp giải:
– Một nguyên tử bao gồm:
+ Lớp vỏ: hạt electron mang điện tích âm, khối lượng 0,00055 amu
+ Hạt nhân:
Hạt proton mang điện tích dương, khối lượng 1 amu
Hạt neutron không mang điện, khối lượng 1 amu
– Kích thước hạt nhân nguyên tử bằng khoảng 10-5 đến 10-4 lần kích thước nguyên tử
Lời giải:
a) Hạt nhân nguyên tử bao gồm: proton và neutron
b) Lớp vỏ nguyên tử gồm: electron
c) Các hạt mang điện trong nguyên tử là: electron (mang điện tích -1), và proton (mang điện tích +1)
d) Kích thước nguyên tử lớn hơn 104 đến 105 lần kích thước hạt nhân.
Bài 5 trang 15 Hóa học 10: Tính tổng số electron, proton và neutron trong một phân tử nước (H2O). Biết trong phân tử này, nguyên tử H chỉ tạo nên từ 1 proton và 1 electron; nguyên tử O có 8 neutron và 8 proton.
Phương pháp giải:
Bước 1: Trong nguyên tử, số proton luôn bằng số electron
=> Từ số proton tìm được số electron
Bước 2: 1 phân tử nước gồm 2 nguyên tử H và 1 nguyên tử O
=> Tổng các hạt trong 1 phân tử nước = 2 x tổng số hạt nguyên tử H + 1 x tổng số hạt nguyên tử O
Lời giải:
– Vì trong nguyên tử, số proton luôn bằng số electron
=> Số hạt electron trong nguyên tử O là 8
=> H có 1 proton, 1 electron và O có 8 proton, 8 electron, 8 neutron
– 1 phân tử nước gồm 2 nguyên tử H và 1 nguyên tử O
=> Tổng số hạt trong 1 phân tử nước = 2 x (1+1) + 1 x (8+8+8) = 28 hạt
Bài giảng Hóa học 10 Bài 2: Thành phần của nguyên tử – Cánh diều
Xem thêm các bài giải SGK Hóa học lớp 10 Cánh diều hay, chi tiết khác:
Bài 1: Nhập môn hóa học
Bài 3: Nguyên tố hóa học
Bài 4: Mô hình nguyên tử và orbital nguyên tử
Bài 5: Lớp, phân lớp và cấu hình electron