Giải bài tập Hóa Học lớp 11 Bài 18: Công nghiệp silicat
Câu hỏi và bài tập (trang 83 sgk Hóa học 11)
Bài 1 trang 83 sgk hóa học 11: Dựa vào các tính chất nào của thủy tinh để tạo ra những vật dụng có hình dạng khác nhau?
Lời giải:
Thủy tinh không có nhiệt độ nóng chảy nhất định. Khi đun nóng, nó mềm dần rồi mới nóng chảy. Do đó, người ta có thể chế tạo ra những vật dụng có hình dạng khác nhau
Bài 2 trang 83 sgk hóa học 11: Một loại thủy tinh có thành phần là Na2SiO3, CaSiO3 và SiO2. Viết phương trình hóa học để giải thích việc dùng axit flohđric để khắc chữ lên thủy tinh đó
Lời giải:
Thành phần của thủy tinh có thể viết như sau: Na2O.CaO.2SiO2
Khi dùng HF tác dụng lên thủy tinh thì có phản ứng sau:
SiO2 + 4HF → SiF4↑ + 2H2O
Nên có thể dùng axit HF để khắc chữ, khắc hình lên thủy tinh.
Bài 3 trang 83 sgk hóa học 11: Một loại thủy tinh thường chứa 13,0% natri oxit; 11,7 % canxi oxit và 75,3% silic đioxit về khối lượng.
Thành phần của thủy tinh này được biểu diễn dưới dạng các oxit là:
A. 2Na2O. CaO. 6SiO2
B. Na2O. CaO. 6SiO2
C. 2Na2O. 6CaO. SiO2
D . Na2O. 6CaO. 6SiO2
Phương pháp giải:
Công thức của thủy tinh có dạng: xNa2O.yCaO.zSiO2
=> công thức của thủy tinh
Lời giải:
Gọi công thức của thuỷ tinh đó là: xNa2O.yCaO.zSiO2
Ta có khối lượng của các oxit tỉ lệ với thành phần phần trăm:
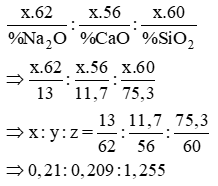
Ta quy về các số nguyên tối giản bằng cách chia cho số nhỏ nhất trong các giá trị trên (0,209) ⇒ x : y : z = 1 : 1 : 6
Thành phần của thủy tinh được biểu diễn dưới dạng oxit: Na2O. CaO. 6SiO2
Đáp án B
Bài 4 trang 83 sgk hóa học 11: Các hợp chất canxi silicat là hợp chất chính của xi măng. Chúng có thành phần như sau: CaO – 73,7%, SiO2 – 26,3% và CaO – 65,1 %, SiO2 – 34,9%. Hỏi trong mỗi hợp chất caxi silicat trên có bao nhiêu mol CaO kết hợp với 1 mol SiO2
Phương pháp giải:
Gọi x và y là số mol tương ứng của oxit CaO và SiO2.
=> từ đó tìm ra được x, y => số mol CaO kết hợp với 1 mol SiO2
Lời giải:
Gọi x và y là số mol tương ứng của oxit CaO và SiO2.
– Ta có x: y = : = 3:1
Thành phần của hợp chất silicat là 3CaO.SiO2
=> 3 mol CaO kết hợp với 1 mol SiO2
– Ta có x : y = : = 2: 1
Thành phần của hợp chất silicat là 2CaO.SiO2
=> 2 mol CaO kết hợp với 1 mol SiO2
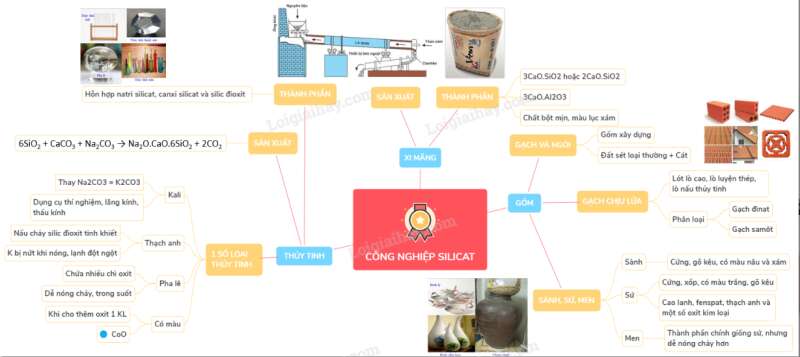
Lý thuyết công nghiệp silicat
Công nghiệp silicat gồm các ngành sản xuất đồ gốm, thủy tinh, xi măng.
A. THỦY TINH
I. THÀNH PHẦN VÀ TÍNH CHẤT HÓA HỌC CỦA THỦY TINH
– Thủy tinh loại thông thường dùng làm cửa kính, chai, lọ, … là hỗn hợp của natri silicat, canxi silicat và silic đioxit.
– Sản xuất bằng cách nấu chảy một hỗn hợp gồm cát trắng, đá vôi và sođa ở 1400oC:
6SiO2 + CaCO3 + Na2CO3 → Na2O.CaO.6SiO2 + 2CO2
– Nhiệt độ nóng chảy xác định do không có cấu trúc tinh thể mà là chất vô định hình.
– Khi đun nóng nó mềm dần rồi mới chảy, do đó có thể tạo ra những đồ vật và dụng cụ có hình dạng như ý muốn.
II. MỘT SỐ LOẠI THỦY TINH
1. Thủy tinh kali
– Khi nấu thủy tinh, nếu thay Na2CO3 bằng K2CO3 thì được thủy tinh kali.
– Có nhiệt độ hóa mềm và nhiệt độ nóng chảy cao hơn.
– Được dùng làm dụng cụ thí nghiệm, lăng kính, thấu kính, …
2. Thủy tinh pha lê
– Là thủy tinh chứa nhiều chì oxit dễ nóng chảy và trong suốt.
3. Thủy tinh thạch anh
– Được sản xuất bằng cách nấu chảy silic đioxit tinh khiết.
– Loại thủy tinh này có nhiệt độ hóa mềm cao, có hệ số nở nhiệt rất nhỏ, nên không bị nứt khi nóng lạnh đột ngột.
4. Thủy tinh có màu
Khi cho thêm oxit của một kim loại, thủy tinh sẽ có màu khác, do tạo nên các silicat có màu.
Ví dụ: crom (III) oxit (Cr2O3) cho thủy tinh màu lục, coban oxit (CoO) cho thủy tinh màu xanh nước biển.
B. GỐM
– Là vật liệu được chế tạo chủ yếu từ đất sét và cao lanh.
– Tùy theo công dụng, người ta phân biệt gốm xây dựng, vật liệu chịu lửa, gốm kĩ thuật và gốm dân dụng.
I. GẠCH VÀ NGÓI
– Gạch và ngói thuộc loại gốm xây dựng.
– Phối liệu để sản xuất chúng gồm đất sét loại thường và một ít cát, được nhào với nước thành khối dẻo, sau đó tạo hình, sấy khô và nung ở 900 − 1000oC sẽ được gạch và ngói. Sau khi nung, gạch và ngói thường có màu đỏ gây nên bởi sắt oxit ở trong đất sét.
II. GẠCH CHỊU LỬA
– Gạch chịu lửa thường được dùng để lót lò cao, lò luyện thép, lò nấu thủy tinh, …
– Có hai loại gạch chịu lửa chính: gạch đinat và gạch samôt.
+ Phối liệu để sản xuất gạch đinat: 93% − 96% SiO2; 4 − 7% CaO và đất sét; nhiệt độ nung khoảng 1300 − 1400oC. Gạch đinat chịu được nhiệt độ khoảng 1690 − 1720oC.
+ Phối liệu để chế tạo gạch samôt: bột samôt trộn với đất sét và nước. Sau đó đóng khuôn và sấy khô, nung ở 1300 − 1400oC.
III. SÀNH, SỨ, MEN
1. Sành
– Sành là vật liệu cứng, gõ kêu, có màu nâu và xám được tạo thành bằng cách nung đất sét ở nhiệt độ khoảng 1200 − 1300oC.
– Để có độ bóng và lớp bảo vệ không thấm nước, người ta tạo một lớp men mỏng ở mặt ngoài của đồ sành.
2. Sứ
– Sứ là vật liệu cứng, xốp, có màu trắng, gõ kêu.
– Phối liệu để sản xuất sứ gồm cao lanh, fenspat, thạch anh và một số oxit kim loại.
– Đồ sứ được nung hai lần, lần đầu ở 1000oC, sau đó tráng men và trang trí, lần thứ hai nung ở nhiệt độ cao hơn, khoảng 1400 − 1450oC.
– Sứ có nhiều loại: sứ dân dụng, sứ kĩ thuật.
– Sứ kĩ thuật được dùng để chế tạo các vật liệu cách điện, tụ điện, buzi đánh lửa, các dụng cụ thí nghiệm.
3. Men
– Thành phần chính giống sứ, nhưng dễ nóng chảy hơn.
– Men được phủ lên bề mặt sản phẩm, sau đó nung lên ở nhiệt độ thích hợp để men biến thành một lớp thủy tinh che kín bề mặt sản phẩm.
C. XI MĂNG
I. THÀNH PHẦN HÓA HỌC
Xi măng thuộc loại vật liệu kết dính quan trọng, là chất bột mịn, màu lục xám, gồm canxi silicat 3CaO.SiO2 hoặc 2CaO.SiO2 và canxi aluminat 3CaO.Al2O3.
II. PHƯƠNG PHÁP SẢN XUẤT
– Xi măng Pooclăng được sản xuất bằng cách nghiền nhỏ đá vôi, trộn với đất sét có nhiều SiO2 và một ít quặng bằng phương pháp khô hoặc phương pháp ướt, rồi nung hỗn hợp trong lò quay hoặc lò đứng ở 1400 − 1600oC.
– Sau khi nung, thu được hỗn hợp màu xám gọi là clanhke.
– Để nguội, rồi nghiền clanhke với một số chất phụ gia thành bột mịn, sẽ được xi măng.
Sơ đồ tư duy: Công nghiệp silicat