Mời các quý thầy cô cùng tham khảo và tải về chi tiết tài liệu dưới đây:
Bài 22: CLO
I. Mục tiêu dạy học
|
NĂNG LỰC, PHẨM CHẤT |
YÊU CẦU CẦN ĐẠT |
MÃ HÓA |
|
|
NĂNG LỰC HÓA HỌC |
|
|
Nhận thức hóa học |
– Phát biểu được trạng thái tự nhiên của Clo |
HH.1.1 |
|
– Mô tả được trạng thái, màu sắc, độ tan của Clo. |
HH.1.2 |
|
|
– Trình bày được xu hướng nhận thêm 1 electron theo cấu hình electron. |
HH.1.3 |
|
|
– Viết được phương trình phản ứng hóa học của clo với kim loại, với khí hidro và với nước |
HH.1.4 |
|
|
– Trình bày cách điều chế khí clo trong PTN và sản xuất khí clo trong công nghiệp. |
HH.1.5 |
|
|
Tìm hiểu thế giới tự nhiên dưới góc độ hóa học |
– Quan sát video thí nghiệm chứng minh tính oxi hóa mạnh của clo: tác dụng với kim loại, với khí hidro và với nước. |
HH.2.1 |
|
Vận dụng kiến thức, kĩ năng đã học |
– Vận dụng kiến thức, kĩ năng đã học để có biện pháp bảo vệ sức khỏe bản thân, gia đình và cộng đồng. |
HH.3.1 |
|
|
NĂNG LỰC CHUNG |
|
|
Năng lực tự chủ và tự học |
Luôn chủ động, tích cực thực hiện những công việc của bản thân trong học tập và trong cuộc sống. |
NL.1 |
|
Năng lực giao tiếp và hợp tác |
Biết chủ động trong giao tiếp và hợp tác làm việc nhóm hiệu quả. |
NL.2 |
|
|
PHẨM CHẤT CHỦ YẾU |
|
|
Chăm chỉ |
Tích cực tìm tòi và sáng tạo trong học tập. |
PC.1 |
|
Trung thực |
Trung thực trong việc báo cáo kết quả thí nghiệm. |
PC.2 |
|
Trách nhiệm |
Có trách nhiệm trong công tác làm việc nhóm, hoàn thành công việc được phân công |
PC.3 |
II. CHUẨN BỊ CỦA GIÁO VIÊN VÀ HỌC SINH
1. Giáo viên
– Thiết kế các phiếu học tập và phần trả lời.
– Powerpoint bài giảng, video thí nghiệm giữa clo với sắt, với khí hidro, video giới thiệu bài học.
– Nam châm, giấy A0 và bút dạ để cho học sinh hoạt động nhóm.
2. Học sinh
– Học bài cũ ở nhà và xem trước nội dung bài mới.
III. TIẾN TRÌNH DẠY HỌC
1. Tiến trình dạy học
|
Hoạt động học (Thời gian) |
Mục tiêu |
Nội dung dạy học trọng tâm |
PP/KTDH chủ đạo |
Phương án đánh giá |
|
Hoạt động 1: Khởi động (5 phút) |
PC.1 PC.3 NL.2 |
– Giới thiệu khái quát về nguyên tố clo. |
– Phương pháp trực quan (sử dụng video) |
Dựa vào câu trả lời của học sinh. |
|
Hoạt động 2: Hình thành kiến thức (30 phút) – Tính chất vật lí của clo (10 phút)
– Tính chất hóa học của clo (15 phút)
– Điều chế clo (5 phút)
|
HH.1.1 HH.1.2 NL.1 NL.2 PC.1 PC.2 PC.3 |
– Tính chất vật lí của clo: trạng thái, màu sắc, tính độc, độ tan.
|
– Phương pháp hoạt động nhóm. – Kỹ thuật mảnh ghép
|
Học sinh hoàn thành sản phẩm và báo cáo kết quả nhóm. |
|
HH.1.3 HH.1.4 HH.2.1 NL.1 NL.2 PC.1 PC.2 PC.3 |
– Tính chất hóa học của clo: tính oxi hóa mạnh
|
– Phương pháp thảo luận nhóm. – Kĩ thuật mảnh ghép |
Học sinh hoàn thành sản phẩm báo cáo kết quả của các nhóm. |
|
|
HH.1.5 NL.1 PC.1 |
– Điều chế khí clo trong PTN và trong công nghiệp |
– Phương pháp trực quan (sử dụng hình ảnh) – Hoạt động cá nhân |
Dựa vào câu trả lời của học sinh |
|
|
Hoạt động 3: Luyện tập (10 phút) |
NL.1 NL.2 PC.1 |
– Viết PTHH của Clo. |
– Hoạt động nhóm |
Dựa vào kết quả báo cáo của từng nhóm. |
2. Các hoạt động học
v Bước 1: Làm việc chung cả lớp (5 phút): GV nêu vấn đề học tập, chia nhóm, giao nhiệm vụ và hướng dẫn hoạt động nhóm.
– GV đặt vấn đề: Trước khi bắt đầu bài học, cả lớp cùng xem video sau và hãy trả lời câu hỏi: khí được nhắc tới trong video là khí gì?
– GV: trình chiếu video đã chuẩn bị
– HS: quan sát video và trả lời câu hỏi.
– GV: Clo là nguyên tố tiêu biểu và quan trọng nhất trong nhóm halogen. Trong chiến trang thế giới lần thứ 2, phát xít Đức đã dùng khí clo để giết người hàng loạt. Vậy tại sao phát xít Đức lại dùng khí clo làm vũ khí hóa học? Clo có tính chất vật lí, tính chất hóa học như thế nào? Clo có những ứng dụng gì và điều chế nó như thế nào?
Bài học hôm nay sẽ giúp cả lớp trả lời được những câu hỏi trên.
– Lớp ta sẽ chia nhóm như sau: (chiếu sơ đồ cách chia nhóm và giải thích)
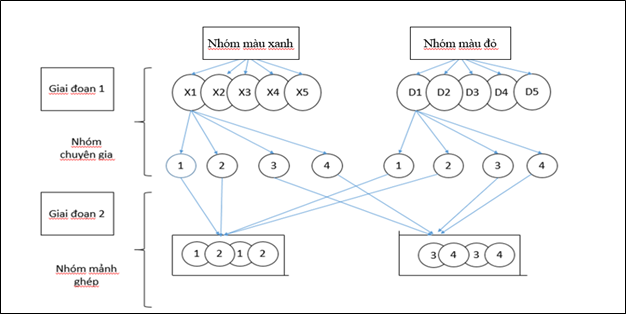
· Giai đoạn 1: Nhóm chuyên gia
– Chia lớp thành 2 loại nhóm (nhóm màu xanh và nhóm màu đỏ), mỗi loại 5 nhóm, mỗi nhóm 4 học sinh, gọi là nhóm chuyên gia.
– Nhiệm vụ của nhóm chuyên gia:
+ nhóm màu đỏ: nghiên cứu về tính chất vật lí và tính chất hóa học của clo: tác dụng với kim loại (có phiếu học tập số 1).
+ nhóm màu xanh: nghiên cứu về tính chất hóa học của clo: tác dụng với khí hidro, với nước và điều chế khí clo.(có phiếu học tập số 2).
– Mỗi nhóm chuyên gia làm việc trong 10 phút.
· Giai đoạn 2: Nhóm mảnh ghép
– Sau khi các nhóm chuyên gia làm việc xong, chia lại nhóm theo nhóm mảnh ghép: cứ 2 chuyên gia của nhóm màu đỏ kết hợp với 2 chuyên gia của nhóm màu xanh tạo thành 1 nhóm mảnh ghép.
– Nhiệm vụ của nhóm mảnh ghép: Các chuyên gia của từng nhóm sẽ đưa ra kết luận mà mình đã nghiên cứu ở giai đoạn 1. Sau đó các nhóm mảnh ghép thảo luận và hoàn thành phiếu học tập số 3.
– Mỗi nhóm mảnh ghép làm việc trong 10 phút.
v Bước 2: Hoạt động nhóm (20 phút)
– HS hoạt động theo nhóm, GV đi đến các nhóm để giám sát hoạt động các nhóm, hướng dẫn HS hoạt động nhóm.
v Bước 3: Thảo luận chung (10 phút)
– GV gọi đại diện 1 nhóm lên trình bày, các nhóm khác đưa ra nhận xét.
– GV tổng kết lại và chiếu lên slide bảng tổng kết kiến thức, cho học sinh xem video phản ứng giữa clo với sắt, khí hidro để kiểm chứng.
v Bước 4: Bài tập củng cố (10 phút)
– GV chiếu bài tập lên slide và mời 1 học sinh lên bảng làm 1 số phản ứng cụ thể.
|
Phiếu học tập số 1 1. Tính chất vật lí cơ bản của clo là gì?
2. Viết cấu hình electron của nguyên tử clo, công thức cấu tạo phân tử clo và nêu các số OXH có thể có của clo.
3. Cả nhóm nghiên cứu sách giáo khoa, thảo luận và ghi kết quả vào bảng sau:
|
|
Phiếu học tập số 2 1. Viết cấu hình electron của nguyên tử clo, công thức cấu tạo phân tử clo và nêu các số OXH có thể có của clo.
2. Dựa vào sách giáo khoa, hãy cho biết có thể điều chế khí clo trong PTN và trong công nghiệp bằng những cách nào?
3. Cả nhóm nghiên cứu sách giáo khoa, thảo luận và ghi kết quả vào bảng sau:
|
|
Phiếu học tập số 3 1. Số OXH đặc trưng của clo là gì? Tại sao clo lại có số OXH đó?
2. Clo có những tính chất hóa học nào? Tại sao clo lại có tính chất đó? Hãy viết PTHH minh họa.
|
|
TỔNG KẾT 1. Số OXH đặc trưng của clo là -1. Vì cấu hình electron của clo là 1s22s22p63s23p5, khi tham gia phản ứng, nguyên tử clo dễ nhận thêm 1electron để thành ion clorua Cl–. 2. Clo có tính chất cơ bản là tính oxi hóa mạnh. Ngoài ra, clo còn có tính khử: – Tính OXH mạnh: 3Cl2 + 2FeCl2 → 2FeCl3 – Tính khử: Cl2 + 2NaOH → NaCl + NaClO + H2O v Nguyên tử clo có 7e lớp ngoài cùng, có độ âm điện lớn nên clo là một phi kim rất hoạt động, có tính oxi hóa mạnh. Ngoài ra, clo có khả năng mất một số electron nên clo cũng thể hiện tính khử. 3. – Giống nhau: đều OXH ion Cl– trong hợp chất. – Khác nhau: + PTN: dùng HCl đặc tác dụng với chất OXH mạnh MnO2 hoặc KMnO4,… → điều chế Cl2 tinh khiết, ít MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O 2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O + Công nghiệp: dùng NaCl, điện phân có màng ngăn; nguyên liệu cần nhiều, phổ biến, rẻ để giá thành hạ → điều chế lượng lớn và thu được các sản phẩm khác: H2, NaOH. 2NaCl + 2H2O → 2NaOH + H2 ↑ + Cl2↑ cực âm cực dương (catot) (anot) 4.
|
BÀI TẬP CỦNG CỐ
Hoàn thành các phương trình phản ứng sau và chỉ ra vai trò của clo trong phản ứng:
1. Na + Cl2 →
2. FeCl2 + Cl2 →
3. Cl2 + SO2 + H2O →
Xem thêm