Lý thuyết Hóa học lớp 10 Bài 2: Thành phần của nguyên tử
A. Lý thuyết Thành phần của nguyên tử
I. Thành phần và cấu trúc của nguyên tử
1. Thành phần nguyên tử
– Mọi vật thể đều được tạo nên từ các chất và mọi chất đều được tạo nên từ các nguyên tử.
– Nguyên tử được tạo nên từ 3 loại hạt cơ bản là:
+ Hạt electron, kí hiệu là e
+ Hạt proton, kí hiệu là p
+ Hạt neutron, kí hiệu là n
– Khối lượng và điện tích các hạt cơ bản này được thể hiện trong Bảng 2.1.
Bảng 2.1. Khối lượng và điện tích của các hạt cấu tạo nên nguyên tử
|
Loại hạt |
Electron |
Proton |
Neutron |
|
Khối lượng (amu) |
0,00055 |
1 |
1 |
|
Điện tích (e0) |
-1 |
+1 |
0 |
– Trong một nguyên tử, số proton và số electron luôn bằng nhau.
– Trong tất cả các nguyên tố, chỉ có duy nhất một loại nguyên tử của hydrogen (H) được tạo nên bởi proton và electron (không có neutron).
Chú ý:
+ Đơn vị của khối lượng nguyên tử là amu (atomic mass unit)
1 amu = 1,6605.10-27 kg
+ Đơn vị của điện tích các hạt cơ bản là e0 (điện tích nguyên tố)
1 e0 = 1,602.10-19 C
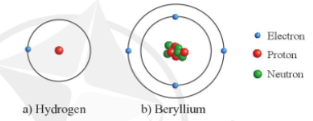
2. Cấu trúc của nguyên tử
Nguyên tử bao gồm:
+ Lớp vỏ: được tạo nên bởi các hạt electron
+ Hạt nhân: được tạo nên bởi các hạt proton và hạt neutron
Ví dụ: Mô hình cấu tạo nguyên tử hydrogen và beryllium
II. Khối lượng và kích thước của nguyên tử
Nguyên tử của các nguyên tố khác nhau có khối lượng và kích thước khác nhau
1. Khối lượng của nguyên tử
– Khối lượng của nguyên tử vô cùng nhỏ.
– Khối lượng nguyên tử thường được biểu thị theo đơn vị amu
– Nguyên tử có khối lượng nhỏ nhất là nguyên tử của nguyên tố hydrogen (H), có khối lượng là 1 amu
– Nguyên tử có khối lượng lớn nhất là nguyên tử của nguyên tố uranium (U), có khối lượng là 238 amu
– Do khối lượng của các electron (0,00055 amu) rất nhỏ so với khối lượng của proton (1 amu) hay neutron (1 amu) nên khối lượng nguyên tử tập trung chủ yếu ở hạt nhân nguyên tử. Một cách gần đúng, có thể coi khối lượng của nguyên tử bằng khối lượng của hạt nhân.
2. Kích thước của nguyên tử
– Kích thước của nguyên tử là vô cùng nhỏ
– Coi nguyên tử có dạng hình cầu, khi đó, đường kính của nó chỉ khoảng 10-10 m
– Nguyên tử có đường kính nhỏ nhất là helium (0,62), nguyên tử có đường kính lớn nhất là francium (7,0)
Chú ý: Angstrom là đơn vị đo độ dài, kí hiệu là
1 = 102 pm = 10-10 m
– Hạt nhân nguyên tử có kích thước rất nhỏ so với nguyên tử. Kích thước hạt nhân bằng khoảng 10-5 đến 10-4 lần kích thước nguyên tử. Như vậy, phần không gian rỗng chiếm chủ yếu trong nguyên tử.
B. Trắc nghiệm Thành phần của nguyên tử
Câu 1. Hạt được tìm thấy ở lớp vỏ nguyên tử là
A. electron
B. proton
C. neutron
D. hạt nhân
Đáp án: A
Giải thích: Hạt được tìm thấy ở lớp vỏ nguyên tử là electron mang điện tích âm.
Câu 2. Biết trong phân thử nước (H2O), nguyên tử H chỉ gồm 1 proton và 1 electron; nguyên tử O có 8 neutron và 8 proton. Tổng số electron, proton và neutron trong một phân tử nước (H2O) là
A. 18
B. 26
C. 20
D. 28
Đáp án: D
Giải thích:
Vì trong nguyên tử số electron bằng số proton nên trong nguyên tử O, số electron là 8 hạt.
Tổng số hạt electron, proton và neutron trong một nguyên tử O là: 8 + 8 + 8 = 24 (hạt).
Tổng số hạt electron, proton và neutron trong một nguyên tử H là: 1 + 1 = 2 (hạt)
Một phân tử nước có 2 nguyên tử H và 1 nguyên tử O.
Vậy tổng số electron, proton và neutron trong một phân tử nước (H2O) là: 2.2 + 24 = 28 (hạt).
Câu 3. Một nguyên tử kali có 19 electron ở lớp vỏ. Điện tích hạt nhân của nguyên tử kali là
A. – 19 eo
B. 0
C. + 19 eo
D. + 38 eo
Đáp án: C
Giải thích:
Vì trong nguyên tử số electron bằng số proton nên trong nguyên tử kali cũng có 19 proton.
Hạt nhân nguyên tử được cấu tạo bởi các hạt proton mang điện tích dương (1 proton có điện tích là + 1 eo) và các hạt neutron không mang điện tích.
Do đó điện tích hạt nhân nguyên tử kali cũng là điện tích của 19 proton là + 19 eo.
Câu 4. Khẳng định nào sau đây đúng?
A. Khối lượng electron xấp xỉ bằng khối lượng proton và lớn hơn khối lượng neutron rất nhiều.
B. Khối lượng neutron xấp xỉ bằng khối lượng proton và lớn hơn khối lượng electron rất nhiều.
C. Khối lượng neutron xấp xỉ bằng khối lượng electron và lớn hơn khối lượng proton rất nhiều.
D. Khối lượng electron, proton và neutron xấp xỉ bằng nhau.
Đáp án: B
Giải thích:
Ta có: me ≈ 0,00055 amu; mp ≈ 1 amu; mn ≈ 1 amu.
Do đó, khối lượng neutron xấp xỉ bằng khối lượng proton và lớn hơn khối lượng electron rất nhiều.
Câu 5. Khẳng định nào sau đây đúng?
A. Khối lượng nguyên tử vô cùng nhỏ. Đơn vị của khối lượng nguyên tử là amu.
B. Khối lượng nguyên tử vô cùng nhỏ. Đơn vị của khối lượng nguyên tử là kg.
C. Khối lượng nguyên tử vô cùng lớn. Đơn vị của khối lượng nguyên tử là amu.
D. Khối lượng nguyên tử vô cùng lớn. Đơn vị của khối lượng nguyên tử là kg.
Đáp án: A
Giải thích: Khối lượng nguyên tử vô cùng nhỏ. Đơn vị của khối lượng nguyên tử là amu (1 amu = 1,6605.10-27 kg)
Câu 6. Tất cả các nguyên tử (trừ duy nhất một loại nguyên tử của hydrogen) được cấu tạo từ các loại hạt cơ bản là
A. hạt electron (e), hạt neutron (n).
B. hạt proton (p), hạt electron (e).
C. hạt electron (e), hạt proton (p), hạt nhân (n).
D. hạt electron (e), hạt proton (p), hạt neutron (n).
Đáp án: D
Giải thích: Tất cả các nguyên tử (trừ duy nhất một loại nguyên tử của hydrogen chỉ được tạo nên bởi một electron và một proton) được cấu tạo từ ba loại hạt cơ bản là hạt electron (e), hạt proton (p), hạt neutron (n).
Câu 7. Nguyên tử trung hòa về điện vì
A. được tạo nên bởi các hạt không mang điện.
B. có tổng số hạt proton bằng tổng số hạt electron.
C. có tổng số hạt electron bằng tổng số hạt neutron.
D. tổng số hạt neutron bằng tổng số hạt neutron.
Đáp án: B
Giải thích:
Một electron có điện tích là – 1 eo
Một proton có điện tích là + 1 eo
Còn neutron không mang điện.
Lại có tổng số hạt proton bằng tổng số hạt electron.
⇒ Tổng điện tích âm bằng tổng điện tích dương
⇒ Nguyên tử trung hòa về điện.
Câu 8. Hạt cơ bản không mang điện trong nguyên tử là
A. electron
B. proton
C. neutron
D. hạt nhân
Đáp án: C
Giải thích:
Hạt cơ bản không mang điện trong nguyên tử là neutron.
Hạt proton mang điện tích dương.
Hạt electron mang điện tích âm.
Câu 9. Loại hạt mang điện trong nguyên tử là
A. hạt nhân
B. electron và neutron
C. electron và proton
D. proton và neutron
Đáp án: C
Giải thích: Loại hạt mang điện trong nguyên tử làproton (điện tích + 1 eo) và electron (điện tích – 1 eo).
Câu 10. Nguyên tử gồm
A. lớp vỏ được tạo nên bởi các hạt eletron và neutron và hạt nhân được tạo nên bởi các hạt proton.
B. lớp vỏ được tạo nên bởi các hạt eletron và hạt nhân được tạo nên bởi các hạt proton và neutron.
C. lớp vỏ được tạo nên bởi các hạt neutron và hạt nhân được tạo nên bởi các hạt proton và eletron.
D. lớp vỏ được tạo nên bởi các hạt proton và eletron và hạt nhân được tạo nên bởi các hạt neutron.
Đáp án: B
Giải thích: Nguyên tử gồm lớp vỏ được tạo nên bởi các hạt eletron và hạt nhân được tạo nên bởi các hạt proton và neutron.
Câu 11. Khối lượng nguyên tử tập trung chủ yếu ở
A. lớp vỏ electron
B. proton
C. neutron
D. hạt nhân nguyên tử
Đáp án: D
Giải thích: Do khối lượng electron rất nhỏ so với khối lượng proton hay neutron nên khối lượng nguyên tử tập trung chủ yếu ở hạt nhân nguyên tử.
Câu 12. Một loại nguyên tử cacbon trong nguyên tử có 6 elctron và 7 neutron. Khối lượng nguyên tử xấp xỉ
A. 6 amu
B. 7 amu
C. 12 amu
D. 13 amu
Đáp án: D
Giải thích:
Số proton = Số electron = 6 hạt
Vì khối lượng ectron rất nhỏ nên:
Khối lượng nguyên tử ≈ khối lượng hạt nhân = khối lượng proton + khối lượng neutron
= 6.1 + 7.1 = 13 (amu)
Câu 13. Khẳng định nào sau đây đúng?
A. Kích thước nguyên tử xấp xỉ bằng kích thước hạt nhân. Nguyên tử có cấu tạo đặc.
B. Kích thước nguyên tử bằng khoảng 3 đến 5 lần kích thước hạt nhân.
C. Kích thước nguyên tử bằng khoảng 10 lần kích thước hạt nhân. Nguyên tử có cấu tạo rỗng.
D. Kích thước nguyên tử bằng khoảng 10000 đến 100000 lần kích thước hạt nhân. Nguyên tử có cấu tạo rỗng.
Đáp án: D
Giải thích: Kích thước nguyên tử bằng khoảng 10000 đến 100000 lần kích thước hạt nhân. Hay hạt nhân nguyên tử có kích thước rất nhỏ so với kích thước nguyên tử. Như vậy, chủ yếu trong nguyên tử là phần không gian rỗng. Do đónguyên tử có cấu tạo rỗng.
Câu 14. Một loại nguyên tử hydrogen có cấu tạo đơn giản nhất, được tạo nên chỉ từ 1 electron và 1 proton. Các phát biểu về nguyên tử hydrogen này như sau:
1) Đây là nguyên tử nhẹ nhất trong số các nguyên tử được biết cho đến nay.
2) Khối lượng nguyên tử xấp xỉ 2 amu.
3) Hạt nhân nguyên tử có khối lượng gấp khoảng 1818 lần khối lượng lớp vỏ.
4) Kích thước nguyên tử bằng kích thước của hạt nhân.
Phát biểu sai là
A. 1, 2
B. 2, 3
C. 1, 4
D. 2, 4
Đáp án: D
Giải thích:
1) Đây là nguyên tử nhẹ nhất trong số các nguyên tử được biết cho đến nay. ⇒ Đúng.
2) Khối lượng nguyên tử xấp xỉ 2 amu. ⇒ Sai. Vì m nguyên tử ≈ m hạt nhân. Mà hạt nhân nguyên tử này chỉ có 1 proton nên m nguyên tử ≈ 1 amu.
3) Hạt nhân nguyên tử có khối lượng gấp khoảng 1818 lần khối lượng lớp vỏ. ⇒ Đúng. Vì me ≈ 0,00055 amu; mp ≈ 1 amu mà lớp vỏ nguyên tử này chỉ có 1 e và hạt nhân chỉ có 1 p. Nên số hạt nhân gấp lớp vỏ số lần là 1 : 0,00055 ≈ 1818.
4) Kích thước nguyên tử bằng kích thước của hạt nhân. ⇒ Sai. Vì kích thước nguyên tử lớn hơn kích thước hạt nhân rất nhiều.
Câu 15. Các đám mây gây hiện tượng sấm sét được tạo nên bởi những hạt nước nhỏ li ti mang điện tích. Một phép đo thực nghiệm cho thấy một giọt nước có đường kính 50 μm mang một điện tích âm là – 3,33.10-17 C. Hãy cho biết điện tích âm của giọt nước trên tương đương với điện tích của bao nhiêu electron.
A. 33 electron
B. 50 electron
C. 150 electron
D. 208 electron
Đáp án: D
Giải thích:
Điện tích của 1 electron là – 1 eo = – 1,602.10-19 C.
Điện tích âm là – 3,33.10-17 C tương đương với điện tích của số electron là
(– 3,33.10-17) : (– 1,602.10-19) ≈ 208 (electron).
Bài giảng Hóa học 10 Bài 2: Thành phần của nguyên tử – Cánh diều
Xem thêm các bài tóm tắt lý thuyết Hóa học 10 Cánh diều hay, chi tiết khác:
Bài 1: Nhập môn hóa học
Bài 3: Nguyên tố hóa học
Bài 4: Mô hình nguyên tử và orbital nguyên tử
Bài 5: Lớp, phân lớp và cấu hình electron