Lý thuyết Hóa học lớp 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
A. Lý thuyết Tính biến thiên enthalpy của phản ứng hóa học
I. Xác định biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết
– Phản ứng hóa học xảy ra khi có sự phá vỡ các liên kết hóa học của chất đầu (cđ) và hình thành các liên kết hóa học của sản phẩm (sp). Sự phá vỡ các liên kết cần cung cấp năng lượng, sự hình thành các liên kết lại giải phóng năng lượng.
– Cho phản ứng tổng quát ở điều kiện chuẩn:
aA (g) + bB (g) → mM (g) + nN (g)
Tính của phản ứng khi biết các giá trị năng lượng liên kết (Eb) theo công thức:
Hay tổng quát:
Với ∑Eb (cđ); ∑Eb (sp): tổng năng lượng liên kết trong phân tử chất đầu và sản phẩm của phản ứng.
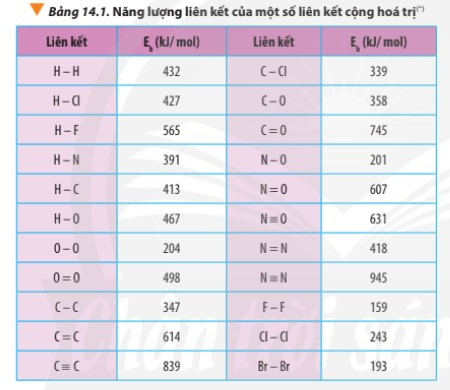
– Ví dụ: Dựa vào bảng năng lượng liên kết (phía trên) tính biến thiên enthalpy của phản ứng: 3H2(g) + N2(g) → 2NH3(g)
= 3.Eb(H2) + Eb(N2) – 2.Eb(NH3)
= 3.Eb(H-H) + Eb(N≡N) – 2.3.Eb(N-H)
= 3.432 + 945 – 2.3.391
= -105 kJ < 0 ⇒ Phản ứng tỏa nhiệt
Chú ý: Tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết được áp dụng cho phản ứng trong đó các chất đều có liên kết cộng hóa trị ở thể khí khi biết giá trị năng lượng liên kết của tất cả các chất trong phản ứng.
II. Xác định biến thiên enthalpy của phản ứng dựa vào enthalpy tạo thành
– Cho phương trình hóa học tổng quát:
aA + bB → mM + nN
– Tổng quát:
Với : tổng enthalpy tạo thành ở điều kiện chuẩn tương ứng của sản phẩm và chất đầu của phản ứng.
– Ví dụ: Tính ∆r phản ứng đốt cháy hoàn toàn benzene C6H6(l) trong khí oxygen.
C6H6(l) + O2(g) 6CO2(g) + 3H2O(l)
∆ r = 6.∆ f(CO2) + 3. ∆ f(H2O) – ∆ f(C6H6) – ∆ f(O2)
∆ r = 6.(-393,50) + 3.(-285,84) – (+49,00) – .0
∆ r = -3267,52 kJ
B. Trắc nghiệm Tính biến thiên enthalpy của phản ứng hóa học
Câu 1. Cho phản ứng:
3O2 (g)⟶2O3 (g)(1)
2O3 (g) ⟶ 3O2 (g)(2)
Biết phân tử O3 gồm 1 liên kết đôi O = O và 1 liên kết đơn O – O.
So sánh của hai phản ứng là
A. (1) > (2);
B. (1) = (2);
C. (1) < (2);
D. (1) ≤ (2).
Hướng dẫn giải
Đáp án đúng là: A
Biến thiên enthalpy chuẩn của phản ứng (1) là:
(1) =
=
= 90 (kJ)
Biến thiên enthalpy chuẩn của phản ứng (2) là:
(2) =
=
= − 90 (kJ)
Do đó: (1) > (2)
Câu 2. Cho phản ứng có dạng: aA + bB ⟶ mM + nN
Công thức tính biến thiên enthalpy phản ứng theo enthalpy tạo thành là
A. =
B. =
C. =
D. =
Hướng dẫn giải
Đáp án đúng là: A
Cho phản ứng có dạng: aA + bB ⟶ mM + nN
Công thức tính biến thiên enthalpy phản ứng theo enthalpy tạo thành là:
=
Câu 3. Cho phản ứng: NH3 (g) + HCl (g) ⟶ NH4Cl (s)
Biết = − 314,4 kJ/mol; = − 92,31 kJ/mol; = − 45,9 kJ/mol.
Biến thiên enthalpy chuẩn của phản ứng tính là
A. – 176,19 kJ;
B. – 314,4 kJ;
C. – 452,61 kJ;
D. 176,2 kJ;
Hướng dẫn giải
Đáp án đúng là: A
Ta có: =
⇒ = (kJ)
Câu 4. Tính của phản ứng đốt cháy 1 mol C2H2 (g) biết các sản phẩm thu được đều ở thể khí.
Cho enthalpy tạo thành chuẩn của các chất tương ứng là
|
Chất |
C2H2 (g) |
CO2 (g) |
H2O (g) |
|
(kJ/mol) |
+ 227 |
− 393,5 |
− 241,82 |
A. – 1270,6 kJ
B. − 1255,82 kJ
C. – 1218,82 kJ
D. – 1522,82 kJ
Hướng dẫn giải
Đáp án đúng là: B
C2H2 (g) + O2 (g) ⟶2CO2 (g) + H2O (g)
của phản ứng đốt cháy 1 mol C2H2 (g) là
=
=
= − 1255,82 (kJ)
Câu 5. Tính của phản ứng đốt cháy 21 gam CO (g) biết các sản phẩm thu được đều ở thể khí.
Cho enthalpy tạo thành chuẩn của các chất tương ứng là
|
Chất |
CO (g) |
CO2 (g) |
O2 (g) |
|
(kJ/mol) |
– 110,5 |
− 393,5 |
0 |
A. – 59,43 kJ;
B. – 283 kJ;
C. − 212,25 kJ;
D. – 3962 kJ.
Hướng dẫn giải
Đáp án đúng là: C
CO (g) + O2 (g) ⟶ CO2 (g)
của phản ứng đốt cháy 1 mol CO (g) là
=
=
= − 283 (kJ)
21 gam CO có số mol là: nCO = = 0,75 (mol)
của phản ứng đốt cháy 21 gam CO (g) là: = − 212,25 (kJ)
Câu 6. Sự phá vỡ liên kết cần ….. năng lượng, sự hình thành liên kết …… năng lượng.
Cụm từ tích hợp điền vào chỗ chấm trên lần lượt là
A. cung cấp, giải phóng;
B. giải phóng, cung cấp;
C. cung cấp, cung cấp;
D. giải phóng, giải phóng.
Hướng dẫn giải
Đáp án đúng là: A
Sự phá vỡ liên kết cần cung cấp năng lượng, sự hình thành liên kết giải phóng năng lượng.
Câu 7. Cho phản ứng có dạng: aA (g) + bB (g) ⟶ mM (g) + nN (g)
Công thức tính biến thiên enthalpy phản ứng theo năng lượng liên kết Eb là
A. =
B. =
C. =
D. =
Hướng dẫn giải
Đáp án đúng là: B
Cho phản ứng có dạng: aA (g) + bB (g) ⟶ mM (g) + nN (g)
Công thức tính biến thiên enthalpy phản ứng theo năng lượng liên kết là:
=
Trong đó, Eb(A), Eb(B), Eb(M), Eb(N) lần lượt là tổng năng lượng liên kết của tất cả các liên kết trong các phân tử A, B, M và N.
Câu 8. Số lượng mỗi loại liên kết trong phân tử CH3Cl là
A. 1 liên kết C – H, 1 liên kết C – Cl;
B. 3 liên kết C – H, 1 liên kết H – Cl;
C. 2 liên kết C – H, 1 liên kết C – Cl;
D. 3 liên kết C – H, 1 liên kết C – Cl.
Hướng dẫn giải
Đáp án đúng là: B
Công thức cấu tạo của CH3Cl là:
Vậy trong 1 phân tử CH3Cl có 3 liên kết C – H, 1 liên kết C – Cl.
Câu 9. Cho phản ứng sau ở điều kiện chuẩn:
2H2 (g) + O2 (g) 2H2O (g)
Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là
A. – 506 kJ;
B. 428 kJ;
C. − 463 kJ;
D. 506 kJ.
Hướng dẫn giải
Đáp án đúng là: A
2H – H (g) + O = O (g) 2H – O – H (g)
Biến thiên enthalpy chuẩn của phản ứng là
=
=
=
= − 506 (kJ)
Câu 10. Cho phản ứng:
4HCl (g) + O2 (g) 2Cl2 (g) + 2 H2O (g)
Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là bao nhiêu? Phản ứng tỏa nhiệt hay thu nhiệt?
A. = − 148 kJ, phản ứng tỏa nhiệt;
B. = − 148 kJ, phản ứng thu nhiệt;
C. = 215 kJ, phản ứng tỏa nhiệt;
D. = 215 kJ, phản ứng thu nhiệt.
Hướng dẫn giải
Đáp án đúng là: A
4H − Cl (g) + O = O (g) 2Cl – Cl (g) + 2H – O – H (g)
Biến thiên enthalpy chuẩn của phản ứng là
=
=
=
= − 148 (kJ)
= − 148 kJ < 0 nên phản ứng tỏa nhiệt.
Câu 11. Tính biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm và cho biết đây là phản ứng tỏa nhiệt hay thu nhiệt.
2Al (s) + Fe2O3 (s) 2Fe (s) + Al2O3 (s)
Biết của Fe2O3 (s) và Al2O3 (s) lần lượt là -825,5 kJ/mol; -1676 kJ/mol
A. = − 850,5 kJ, phản ứng tỏa nhiệt;
B. = − 850,5 kJ, phản ứng thu nhiệt;
C. = − 2501,5 kJ, phản ứng tỏa nhiệt;
D. = − 2501,5 kJ, phản ứng thu nhiệt.
Hướng dẫn giải
Đáp án đúng là: A
2Al (s) + Fe2O3 (s) 2Fe (s) + Al2O3 (s)
Ta có:
=
=
= − 850,5 (kJ)
Vậy = − 850,5 kJ < 0 nên phản ứng tỏa nhiệt.
Câu 12. Để tính biến thiên enthalpy phản ứng theo năng lượng liên kết, phải viết được
A. công thức phân tử của tất cả các chất trong phản ứng
B. công thức cấu tạo của tất cả các chất trong phản ứng
C. công thức đơn giản nhất của tất cả các chất trong phản ứng
D. Cả A, B và C đều sai
Hướng dẫn giải
Đáp án đúng là: B
Ta có: = (cđ) – (sp)
Với (cđ); (sp) là tổng năng lượng liên kết trong phân tử chất đầu và sản phẩm của phản ứng.
Do đó, để tính biến thiên enthalpy phản ứng theo năng lượng liên kết, phải viết được công thức cấu tạo của tất cả các chất trong phản ứng để xác định được số lượng và loại liên kết.
Câu 13. Tính lượng nhiệt sinh ra khi đốt cháy hoàn toàn 7,8 gam C6H6 (l)
Cho enthalpy tạo thành chuẩn của các chất tương ứng là
|
Chất |
C6H6 (l) |
CO2 (g) |
H2O (g) |
|
(kJ/mol) |
+49 |
− 393,5 |
-241,82 |
A. 3135,46 kJ;
B. 684,32 kJ;
C. 313,546 kJ;
D. 68,432 kJ.
Hướng dẫn giải
Đáp án đúng là: C
C6H6 (l) + O2 (g) ⟶ 6CO2 (g) + 3H2O (g)
=
=
= − 3135,46 (kJ)
Do đó, đốt cháy 1 mol C6H6 thì lượng nhiệt sinh ra là 3135,46 kJ
7,8 gam C6H6 (l) có số mol là: = 0,1 (mol).
Vậy đốt cháy 0,1 mol C6H6 thì lượng nhiệt sinh ra là 3135,46.0,1 = 313,546 (kJ)
Câu 14. Cho phương trình nhiệt hóa học sau:
SO2 (g) + O2 (g) SO3 (g) = − 98,5 kJ
Lượng nhiệt giải phóng ra khi chuyển 76,8 gam SO2 (g) thành SO3 (g) là
A. 98,5 kJ;
B. 118,2 kJ;
C. 82,08 kJ;
D. 7564,8 kJ.
Hướng dẫn giải
Đáp án đúng là: B
SO2 (g) + O2 (g) SO3 (g) = − 98,5 kJ
Theo phương trình nhiệt hóa học, ta có cứ chuyển 1 mol SO2 (g) thành SO3 (g) thì lượng nhiệt giải phóng là 98,5 kJ.
76,8 gam SO2 (g) có số mol là: = 1,2 (mol)
Vậy chuyển 76,8 gam SO2 (g) thành SO3 (g) thì lượng nhiệt giải phóng là:
98,5.1,2 = 118,2 (kJ)
Câu 15. Cho phương trình nhiệt hóa học sau:
2H2 (g) + O2 (g) ⟶ 2H2O (g) = − 483,64 kJ
So sánh đúng là
A. (cđ) >(sp);
B. (cđ) = (sp);
C. (cđ) <(sp);
D. (cđ) ≤ (sp).
Hướng dẫn giải
Đáp án đúng là: A
Ta có: = (sp) – (cđ)
Với (cđ); (sp) là tổng enthalpy tạo thành ở điều kiện chuẩn của chất đầu và sản phẩm của phản ứng.
Xét phương trình nhiệt hóa học:
2H2 (g) + O2 (g) ⟶ 2H2O (g) = − 483,64 kJ
Ta thấy: = − 483,64 kJ < 0
Nên (sp) – (cđ) < 0
Do đó: (sp) <(cđ) hay (cđ) >(sp).
Bài giảng Hóa học 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học – Chân trời sáng tạo
Xem thêm các bài tóm tắt lý thuyết Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA