Giải SBT Hoá học lớp 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Bài 14.1 trang 56 SBT Hóa học 10. Trình bày cách tính enthalpy của phản ứng hóa học dựa vào năng lượng liên kết và dựa vào enthalpy tạo thành của các chất.
Lời giải:
Cho phản ứng tổng quát ở điều kiện chuẩn:
aA (g) + bB (g) → mM (g) + nN (g)
– Tính của phản ứng khi biết các giá trị năng lượng liên kết (Eb) theo công thức:
Hay tổng quát:
Với ∑Eb (cđ); ∑Eb (sp): tổng năng lượng liên kết trong phân tử chất đầu và sản phẩm của phản ứng.
– Có thể tính được biến thiên enthalpy chuẩn của một phản ứng hóa học () khi biết các giá trị của tất cả các chất đầu và sản phẩm theo công thức sau:
Tổng quát:
Với : tổng enthalpy tạo thành ở điều kiện chuẩn tương ứng của sản phẩm và chất đầu của phản ứng.
Bài 14.2 trang 56 SBT Hóa học 10. Cho phản ứng tổng quát: . Hãy chọn các phương án tính đúng của phản ứng:
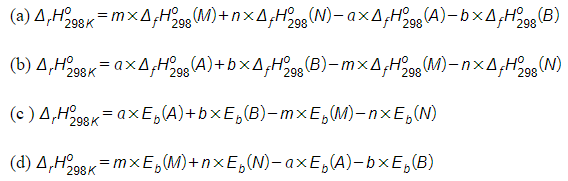
Lời giải:
Các phương án đúng là (a) và (c).
Giải thích:
– Cách tính enthalpy của phản ứng hoá học dựa vào năng lượng liên kết:
Với : tổng năng lượng liên kết trong phân tử chất đầu và sản phẩm của phản ứng.
– Cách tính enthalpy của phản ứng hoá học dựa vào enthalpy tạo thành:
Với : tổng enthalpy tạo thành ở điều kiện chuẩn của sản phẩm và chất đầu của phản ứng
Bài 14.3 trang 56 SBT Hóa học 10. Thành phần chính của đa số các loại đá dùng trong xây dựng là CaCO3, chúng vừa có tác dụng chịu nhiệt, vừa chịu được lực. Dựa vào bảng 13.1 SGK trang 84, tính của phản ứng:
Phản ứng có xảy ra thuận lợi ở điều kiện thường không?
Lời giải:
Phản ứng:
= – 635,1 + (-393,5) – (-1 206,9) = +178,3 kJ/mol
Phản ứng không xảy ra ở điều kiện thường, do > 0.
Bài 14.4 trang 56 SBT Hóa học 10. Propene là nguyên liệu cho sản xuất nhựa polypropylene (PP). PP được sử dụng để sản xuất các sản phẩm ống, màng, dây cách điện, kéo sợi, đồ gia dụng và các sản phẩm tạo hình khác.

Phản ứng tạo thành propene từ propyne:
a) Hãy xác định số liên kết trong hợp chất (propyne)
b) Từ năng lượng của các liên kết (Bảng 14.1, SGK trang 89), hãy tính biến thiên enthalpy của phản ứng tạo thành propene trên.
Lời giải:
a) Công thức cấu tạo đầy đủ của propyne:

Trong hợp chất số liên kết C-H là 4; C-C là 1; C≡C là 1.
b) Biên thiên enthalpy của phản ứng:
= 839 kJ/mol, Eb(H-H) = 432 kJ/mol.
![]()
= 839 + 347 + 4.413 + 432 – 614 – 347 – 6.413 = -169 kJ.
Bài 14.5 trang 57 SBT Hóa học 10. Tính nhiệt tạo thành chuẩn của HF và NO dựa vào năng lượng liên kết (Bảng 14.1 SGK), của F2, H2, HF, N2, O2, NO. Giải thích sự khác nhau về nhiệt tạo thành của HF và NO.
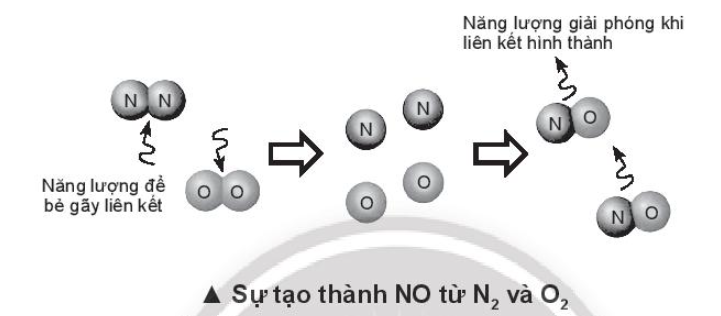
Lời giải:
Áp dụng công thức:
= 945 kJ/mol,
Eb(O=O) = 498 kJ/mol; Eb(N≡O) = 631 kJ/mol;
Nhiệt tạo thành 1 mol HF:
432 + 159 – 2.565 = -539 kJ < 0
⇒ Phản ứng xảy ra.
Nhiệt tạo thành 1 mol NO:
(NO) = 945 + 498 – 2.631 = +181 kJ > 0
⇒ Phản ứng không xảy ra
Bài 14.6 trang 57 SBT Hóa học 10. Phosgene là chất khí không màu, mùi cỏ mục, dễ hóa lỏng; khối lượng riêng 1,420 g/cm3 (ở 0oC); ts = 8,2 oC. Phosgene ít tan trong nước; dễ tan trong các dung môi hữu cơ, bị thủy phân chậm bằng hơi nước; không cháy; là sản phẩm công nghiệp quan trọng; dùng trong tổng hợp hữu cơ để sản xuất sản phẩm nhuộm, chất diệt cỏ, polyurethane, …
Phosgene là một chất độc. Ở nồng độ 0,005 mg/L đã nguy hiểm đối với người; trong khoảng 0,1 – 0,3 mg/L, gây tử vong sau khoảng 15 phút.
Phosgene được điều chế bằng cách cho hỗn hợp CO và Cl2 đi qua than hoạt tính. Biết: Eb(Cl-Cl) = 243 kJ/mol; Eb(C-Cl) = 339 kJ/mol; Eb(C=O) = 745 kJ/mol;
Eb(C ≡ O) = 1075 kJ/mol.
Hãy tính biến thiên enthalpy của phản ứng tạo thành phosgene từ CO và Cl2.
Lời giải:
Phản ứng hoá học: (Phosgene)
Áp dụng công thức:
= 1075 + 243 – 2.339 – 745 = – 105 kJ
Bài 14.7 trang 57 SBT Hóa học 10. Kim loại nhôm có thể khử được oxide của nhiều nguyên tố. Dựa vào nhiệt tạo thành chuẩn của các chất (Bảng 13.1 SGK), tính biến thiên enthalpy của phản ứng nhôm khử 1 mol mỗi oxide sau:
a. Fe3O4 (s)
b. Cr2O3 (s)
Lời giải:
Áp dụng công thức:
a)
(1) = 4.(-1 676,00) – 3.(-1 121,00) = -3 341,00 kJ
Biến thiên enthalpy của phản ứng nhôm khử 1 mol Fe3O4 là
b)
(2)= -1 676,00 – (-1 128,60) = -547,4 kJ
Biến thiên enthalpy của phản ứng nhôm khử 1 mol Cr2O3 là
1. (2) = -547,4 kJ
Bài 14.8* trang 58 SBT Hóa học 10. Cho 3 hydrocarbon X, Y, Z đều có 2 nguyên tử C trong phân tử. Số nguyên tử H trong các phân tử tăng dần theo thứ tự X, Y, Z.
a) Viết công thức cấu tạo của X, Y, Z.
b) Viết phương trình đốt cháy hoàn toàn X, Y, Z với hệ số nguyên tối giản.
c) Tính biến thiên enthalpy của mỗi phản ứng dựa vào enthalpy tạo thành tiêu chuẩn trong bảng sau.

d) Từ kết quả tính toán đưa ra kết luận về ứng dụng của phản ứng đốt cháy X, Y, Z trong thực tiễn.
Lời giải:
a) Ba hydrocarbon X, Y, Z lần lượt là HC≡CH (ethyne hay acetylene),
H2C=CH2 (ethene hay ethylene), H3C-CH3 (ethane).
b) Phản ứng hoá học xảy ra:
c)
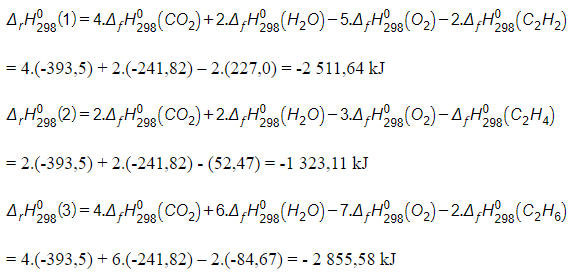
d) Kết quả tính toán của phản ứng đốt cháy acetylene; ethylene; ethane giá trị lớn và < 0 (giải phóng năng lượng lớn) nên trong thực tiễn được sử dụng làm nhiên liệu. Riêng C2H2 trong thực tiễn làm đèn xì acetylene vì đèn xì acetylene có nhiệt độ cao nhất.
Bài 14.9 trang 58 SBT Hóa học 10. Cho các phản ứng:
a) Phản ứng nào có thể tự xảy ra (sau giai đoạn khơi mào ban đầu), phản ứng nào không thể tự xảy ra?
b) Khối lượng ethanol hay graphite cần dùng khi đốt cháy hoàn toàn đủ tạo lượng nhiệt cho quá trình nhiệt phân hoàn toàn 0,1 mol CaCO3. Giả thiết hiệu suất các quá trình đều là 100%.
Lời giải:
a) Phản ứng nung vôi không tự xảy ra do > 0 nên cần nguồn nhiệt ngoài.
Hai phản ứng còn lại có thể tự xảy ra sau giai đoạn khơi mào do < 0.
b) Lượng nhiệt cần đề thu được 0,1 mol CaO là 0,1.178,49 = +17,849 kJ. Vậy:
– Lượng C2H5OH(l) cần dùng: .
Lượng C(graphite,s) cần dùng :
Bài 14.10 trang 58 SBT Hóa học 10. Lactic acid hay acid sữa là hợp chất hóa học đóng vai trò quan trọng trong nhiều quá trình sinh hóa, lần đầu tiên được phân tách vào năm 1780 bởi nhà hóa học Thụy Điển Carl Wilhelm Scheele. Lactic acid có công thức phân tử C3H6O3, công thức cấu tạo CH3-CH(OH)-COOH.
Khi vận động mạnh cơ thể không đủ cung cấp oxygen, thì cơ thể sẽ chuyển hóa glucose thành lactic acid từ các tế bào để cung cấp năng lượng cho cơ thể (lactic acid tạo thành từ quá trình này sẽ gây mỏi cơ) theo phương trình sau:
Biết rằng cơ thể chỉ cung cấp 98% năng lượng nhờ oxygen, năng lượng còn lại nhờ vào sự chuyển hóa glucose thàng lactic acid.
Giả sử một người chạy bộ trong một thời gian tiêu tốn 300 kcal. Tính khối lượng lactic acid tạo ra từ quá trình chuyển hóa đó (biết 1 cal = 4,184 J).
Lời giải:
Tính khối lượng lactic acid tạo ra từ quá trình chạy bộ. Năng lượng của sự chuyển hoá glucose thành lactic acid trong quá trình chạy bộ chiếm
2% . 300 kcal = 6 kcal = 6 000 cal ⟺ 25 104 J = 25,104 kJ.
C6H12O6 → 2C3H6O3
0,335 mol ← -25,104 kJ
Khối lượng lactic acid được tạo ra trong quá trình chuyển hoá:
0,335.90 = 30,15 g.
Bài 14.11 trang 59 SBT Hóa học 10. Chloromethane (CH3Cl), còn được gọi là methyl chloride, Refrigerant-40 hoặc HCC 40. CH3Cl từng được sử dụng rộng rãi như một chất làm lạnh. Hợp chất khí này rất dễ cháy, có thể không mùi hoặc mùi thơm nhẹ.
Từ năng lượng của các liên kết (Bảng 14.1 SGK), hãy tính biến thiên enthalpy của phản ứng tạo thành chloromethane:
CH4 (g) + Cl2 (g) → CH3Cl (g) + HCl (g)
Cho biết phản ứng dễ dàng xảy ra dưới ánh sáng mặt trời. Kết quả tính có mâu thuẫn với khả năng dễ xảy ra của phản ứng không.
Lời giải:
Dựa vào công thức tính theo năng lượng liên kết cho phản ứng:
CH4 (g) + Cl2 (g) → CH3Cl (g) + HCl (g)
= 4.Eb(C-H) + Eb(Cl-Cl) – [3. Eb(C-H) + Eb(C-Cl)] – Eb(H-Cl)
= 4.413 + 243 – (3.413 + 339) – 427 = -110 kJ.
Phản ứng có < 0 nên thuận lợi về mặt nhiệt nên có thể tự xảy ra.
Kết quả tính hoàn toàn phù hợp với thực tế phản ứng xảy ra dễ dàng.
Bài 14.12* trang 59 SBT Hóa học 10. Một xe tải đang vận chuyển đất đèn (thành phần chính là CaC2 và CaO) gặp mưa xảy ra sự cố, xe tải đã bốc cháy.
a. Viết phản ứng của CaC2 và CaO với nước.
b. Xe tải bốc cháy do các phản ứng trên tỏa nhiệt kích thích phản ứng cháy của acetylene:
Dựa vào Bảng 13.1 SGK, tính biến thiên enthalpy của các phản ứng trên. Cho biết phản ứng tỏa nhiệt hay thu nhiệt.
Lời giải:
a) Các phản ứng xảy ra:
b) Phản ứng cháy:
![]()
= 2.(-393,50) + (-241,82) – (+227,00)- .0 = -1 255,82 kJ
Do < 0 nên phản ứng toả nhiệt.
Bài 14.13 trang 59 SBT Hóa học 10. Cho phương trình hóa học của phản ứng:
Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành chuẩn của các chất (Bảng 13.1 SGK)
Lời giải:
Phản ứng:
Biến thiên enfhalpy của phản ứng tính theo nhiệt tạo thành chuẩn:
= – 277,63 – (+52,47) – (-285,84) = -44,26 kJ
Do < 0 nên phản ứng toả nhiệt.
Bài 14.14* trang 59 SBT Hóa học 10. Cho phản ứng phân hủy hydrazine:
a. Tính theo năng lượng liên kết của phản ứng trên.
b. Hydrazine (N2H4) là chất lỏng ở điều kiện thường (sôi ở 114oC, khối lượng riêng 1,021 g/cm3). Hãy đề xuất lí do N2H4 được sử dụng làm nhiên liệu trong động cơ tên lửa. Biết: Eb(N-N) = 160 kJ/mol; Eb(N-H) = 391 kJ/mol; Eb(N ≡ N) = 945 kJ/mol; Eb(H-H) = 432 kJ/mol.
Lời giải:
a) Hydrazine có công thức cấu tạo: H2N-NH2. Một phân tử hydrazine có 1liên kết đơn N-N (Eb = 160 kJ/mol); 4 liên kết đơn N-H (Eb = 391 kJ/mol). N2 có1 liên kết ba N≡N (Eb = 945 kJ/mol), H2 có 1 liên kết đơn H-H (Eb = 432 kJ/mol).
Áp dụng công thức tính. theo năng lượng liên kết:
= Eb(N-N) + 4.Eb(N-H) – Eb(N≡N) – 2.E(H-H)
= 160 + 4.391 – 945 – 2.432 = -85 kJ
b) Lí do N2H4 được sử dụng làm nhiên liệu trong động cơ tên lửa:
– N2H4 là chất lỏng ở điều kiện thường nên dễ bảo quản (nếu là chất khí cần nén ở áp suất cao gây nguy hiểm).
– Khối lượng riêng nhỏ nên nhẹ, phù hợp với nhiên liệu động cơ tên lửa (nếu nặng sẽ gây tốn năng lượng). = – 85 kJ < 0 nên phản ứng có thẻ tự xảy ra mà không cần nguồn nhiệt ngoài.
– Giả sử 1 mol N2H4 lỏng phản ứng (có thẻ tích khá nhỏ) sẽ sinh ra 3 mol khí có thể tích lớn hơn rất nhiều nên sẽ tạo được luồng khí đây tên lửa đi.
Bài 14.15 trang 59 SBT Hóa học 10. Quá trình hòa tan calcium chloride trong nước:
|
Chất |
CaCl2 |
Ca2+ |
Cl– |
|
|
-795,0 |
-542,83 |
-167,16 |
Tính biến thiên enthapy của quá trình.
Lời giải:
Enthalpy của quá trình:
= – 542,83 – 167,16 – (-795,00) = 85,01 kJ.
Xem thêm các bài giải SBT Hoá học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Bài 14: Tính biến thiên enthalpy của phản ứng hóa học
Ôn tập chương 5
Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học