Giải bài tập Hóa học lớp 11 Bài 29: Anken
Câu hỏi và bài tập( trang 132 SGK Hóa học 11)
Bài 1 trang 132 SGK Hóa học 11: So sánh anken với ankan về đặc điểm cấu tạo và tính chất hóa học. Cho thí dụ minh họa.
Lời giải :

Bài 2 trang 132 SGK Hóa học 11: Ứng với công thức C5H10 có bao nhiêu đồng phân cấu tạo ?
A. 4 B. 5 C. 3 D. 7
Phương pháp giải:
Anken có các loại đồng phân:
– Đồng phân về mạch C:
+ mạch không phân nhánh
+ mạch nhánh
– Đồng phân về vị trí liên kết đôi
– Đồng phân cis – trans (đồng phân hình học)
Lời giải :
Các đồng phân cấu tạo của C5H10 là :
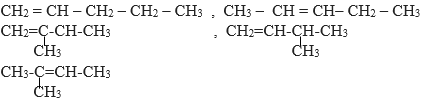
=> có 5 công thức
Đáp án B
Bài 3 trang 132 SGK Hóa học 11: Viết phương trình hóa học của phản ứng xảy ra khi;
a) Propilen tác dụng với hiđro, đun nóng (xúc tác Ni).
b) But – 2 – en tác dụng với hirdo clorua.
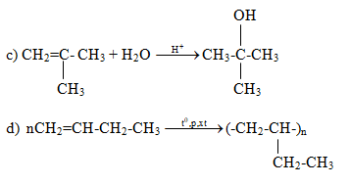
c) Metylpropen tác dụng với nước có xúc tác axit
d) Trùng hợp but – 1 – en.
Lời giải :
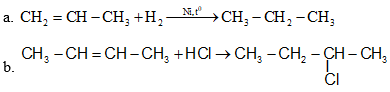
Bài 4 trang 132 SGK Hóa học 11: Trình bày phương pháp hóa học để :
a ) Phân biệt metan và etilen.
b ) Tách lấy khí metan từ hỗn hợp etilen.
c) Phân biệt hai bình không dán nhãn đựng hexan và hex-1-en.
Viết phương trình hóa học của các phản ứng đã dùng.
Phương pháp giải :
a) metan thuộc ankan, etilen thuộc anken => dựa vào tính chất hóa học khác nhau của 2 chất này để chọn chất phân biệt được chúng
vd: dung dịch nước brom
b) tương tự a)
c) hexan và hex-1-en cũng 1 chất thuộc ankan và 1 chất thuộc anken => dựa vào tính chất hóa học đặc trưng của chúng để nhận biết
Lời giải :
a) Lần lượt cho metan và etilen đi qua dung dịch nước brom, chất nào làm dung dịch nước brom nhạt màu thì đó là etilen, chất nào không làm dung dịch nước brom nhạt màu thì đó là metan.
CH2=CH2 + Br2 ( dd màu nâu đỏ) → CH2Br-CH2Br (dd không màu)
CH4 không tác dụng với dung dịch nước brom
b) Cho hỗn hợp khí (CH4 và C2H4) đi qua dung dịch nước brom dư, C2H4 sẽ tác dụng với dung dịch nước brom, khí còn lại ra khỏi bình dung dịch nước brom là CH4.(PTHH như câu a)
c) Lần lượt cho hexan và hex-1-en đi qua dung dịch nước brom
+ chất nào làm dung dịch nước brom nhạt màu thì đó là etilen
CH2=CH-[CH2]3-CH3 + Br2 ( dd màu nâu đỏ) → CH2Br-CHBr-[CH2]3-CH3 (dd không màu)
+ chất nào không làm dung dịch nước brom nhạt màu thì đó là hexan vì hexan không tác dụng với dung dịch nước brom
Bài 5 trang 132 SGK Hóa học 11: Chất nào sau đây làm mất màu dung dịch brom?
A. butan ; B. but-1-en ;
C.cacbon đioxit ; D. metylpropan.
Lời giải:
: dung dịch màu nâu đỏ
: dung dịch không màu.
Đáp án B
Bài 6 trang 132 SGK Hóa học 11: Dẫn từ từ 3,36 lít hỗn hợp gồm etilen và propilen (đktc) vào dung dịch brom thấy dung dịch bị nhạt màu và không có khí thoát ra. Khối lượng dung dịch sau phản ứng tăng 4,90gam.
a) Viết các phương trình hóa học và giải thích các hiện tượng ở thí nghiệm trên.
b) Tính thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp ban đầu.
Phương pháp giải:
a) CH2 = CH2 + Br2 CH2Br – CH2Br
CH2 = CH – CH3 + Br2 CH2Br – CHBr – CH3
b)
Gọi x,y lần lượt là số mol của C2H4 và C3H6 :
%V C2H4 = ?%
%V C3H6 = ? %
Lời giải:
a) Các phương trình hóa học của phản ứng:
CH2 = CH2 + Br2 CH2Br – CH2Br
CH2 = CH – CH3 + Br2 CH2Br – CHBr – CH3
Giải thích: Dung dịch brom bị nhạt màu do brom phản ứng với hỗn hợp tạo thành các hợp chất không màu. Khối lượng bình tăng do các sản phẩm tạo thành là những chất lỏng
b) Gọi x,y lần lượt là số mol của C2H4 và C3H6 :
(mol)
Khối lượng dung dịch sau phản ứng tăng lên chính là tổng khối lượng của C2H4 và C3H6
Ta có hệ phương trình
%V C2H4 = 66,7%
%V C3H6 = 33,3%
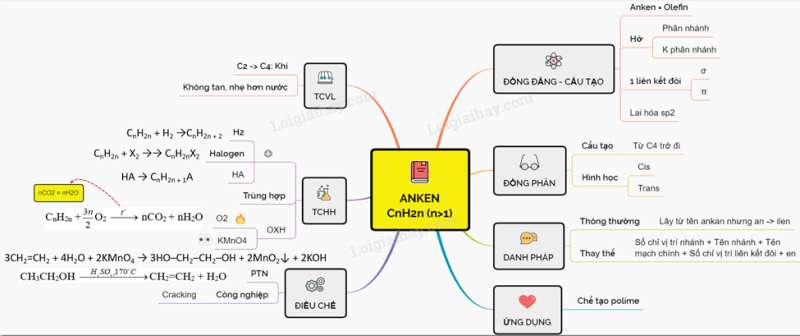
Lý thuyết Bài 29: anken
I. ĐỒNG ĐẰNG, ĐỒNG PHÂN, DANH PHÁP
1. Đồng đằng, cấu tạo
– CTTQ dãy đồng đẳng CnH2n(n 2)
– Tên gọi chung là anken hay olefin.
– Công thức đơn giản nhất là etilen (CH2=CH2).
– Mạch cacbon hở, có thể phân nhánh hoặc không phân nhánh.
– Trong phân tử có 1 liên kết đôi: gồm 1 liên kết σ và 1 liên kết π. Nguyên tử cacbon ở liên kết đôi tham gia 3 liên kết σ nhờ obitan lai hóa sp2, còn liên kết π nhờ obitan p không lai hóa.
– Đặc biệt phân tử CH2=CH2 có cấu trúc phẳng.
2. Đồng phân
a) Đồng phân cấu tạo
Anken từ C4H8 trở đi có đồng phân cấu tạo mạch cacbon và vị trí nối đôi.
b) Đồng phân hình học
– Nếu mỗi C mang liên kết đôi dính với 2 nhóm nguyên tử khác nhau thì sẽ có 2 cách phân bố không gian khác nhau là đồng phân cis và trans.
– Cách đọc tên đồng phân hình học: ghi tiền tố cis- trans- trước tên gọi anken
3. Danh pháp
– Tên thông thường của một số ít anken lấy tên từ ankan tương ứng, nhưng đổi hậu tố an thành ilen.
Ví dụ: CH2=CH2: etilen
CH2=CH–CH3: Propilen
– Tên thay thế: số chỉ vị trí nhánh – Tên nhánh + Tên mạch chính – Số chỉ vị trí liên kết đôi – en
Ví dụ: CH2=CH-CH2-CH3: But–1–en.
CH3-CH=CH-CH3: But–2–en.
II. TÍNH CHẤT VẬT LÍ
– Ở điều kiện thường, các anken từ C2 C4 ở dạng khí, từ C5 trở đi là chất lỏng hoặc rắn
– Nhiệt độ sôi, nhiệt độ nóng chảy và khối lượng riêng tăng dần theo chiều tăng của phân tử khối
– Anken nhẹ hơn nước và không tan trong nước
III. TÍNH CHẤT HÓA HỌC
Trong phân tử anken có 1 kém bền nên có phản ứng đặc trưng là phản ứng cộng
1. Phản ứng cộng
– Cộng hiđro : CnH2n + H2 CnH2n + 2
– Cộng halogen: CnH2n + X2 CnH2nX2
– Cộng HA: Cộng nước, hiđro halogenua, axit sulfuric đậm đặc,…
PTTQ: CnH2n+ HA CnH2n + 1A (A là X, OSO3H, OH,…)
*Lưu ý: Phản ứng cộng HA vào anken không đối xứng tuân theo Quy tắc Mac – cop –nhi – côp: “ nguyên tử H ưu tiên cộng vào nguyên tử cacbon bậc thấp hơn ở nối kép , A ưu tiên cộng vào nguyên tử cacbon bậc cao hơn”
2. Trùng hợp
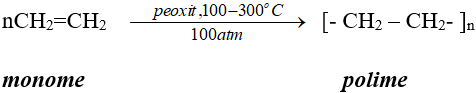
– Phản ứng trùng hợp là quá trình cộng hợp liên tiếp nhiều phân tử nhỏ giống nhau hoặc tương tự nhau tạo thành phân tử lớn gọi là polime.
– Số lượng mắt xích trong một phân tử polime gọi là hệ số trùng hợp, kí hiệu n.
3. Phản ứng oxi hóa
– Anken cháy hoàn toàn tạo thành CO2 và H2O và tỏa nhiều nhiệt.
![]()
Nhận xét: Đốt anken thu nCO2 = nH2O
– Anken làm mất màu dung dịch KMnO4 (phản ứng được dùng để nhận ra sự có mặt của liên kết đôi) và bị oxi hóa không hoàn toàn thành hợp chất điol.
3CH2=CH2 + 4H2O + 2KMnO4 → 3HO–CH2–CH2–OH + 2MnO2↓ + 2KOH
=> Anken làm mất màu dd KMnO4 → Dùng để nhận biết anken.
IV. ĐIỀU CHẾ
– Trong phòng TN, etilen được điều chế từ ancol etylic
![]()
– Trong công nghiệp, các anken được điều chế từ ankan
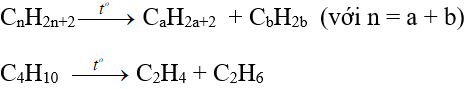
V. ỨNG DỤNG
– Trùng hợp etilen, propilen, butilen người ta thu được các polime để chế tạo màng mỏng, bình chứa, ống dẫn nước, … dùng cho nhiều mục đích khác nhau.
– Chuyển hoá etilen thành các monome khác để tổng hợp ra hàng loạt polime đáp ứng nhu cầu phong phú của đời sống và kĩ thuật.
– Từ etilen tổng hợp ra những hoá chất hữu cơ thiết yếu như etanol, etilen oxit, etylen glicol, anđehit axetic, …
Sơ đồ tư duy: Anken