Giải SBT Hóa học 11 Bài 32: Ankin
Bài 32.1 trang 49 SBT Hóa học 11: Chất
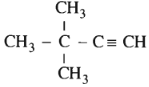 có tên là gì ?
có tên là gì ?
A. 2,2-đimetylbut-1-in
B. 2,2-đimetylbut-3-in
C. 3,3-đimetylbut-1-in
D. 3,3-đimetylbut-2-in
Lời giải:
Hợp chất trên có tên là: 3,3-đimetylbut-1-in
Chọn C.
Bài 32.2 trang 49 SBT Hóa học 11: Có 4 chất : metan, etilen, but-1-in và but-2-in. Trong 4 chất đó, có mấy chất tác dụng được với dung dịch trong amoniac tạo thành kết tủa ?
A. 4 chất B. 3 chất
C. 2 chất D. 1 chất.
Lời giải:
Chỉ có các ank – 1 – in có phản ứng thế ion kim loại tương tự như axetilen.
Vậy trong 4 chất trên chỉ có but-1-in tác dụng được với dung dịch trong amoniac tạo thành kết tủa
Chọn D.
Bài 32.3 trang 49 SBT Hóa học 11: Nhận xét nào sau đây là sai?
A. Các ankin đều cháy khi được đốt trong oxi.
B. Các ankin đều làm mất màu dung dịch KMnO4.
C. Các ankin đều tác dụng với hiđro ở nhiệt độ cao, có chất xúc tác Ni.
D. Các ankin đều tác dụng với dung dịch AgNO3 trong amoniac.
Lời giải:
Chỉ có các ank – 1 – in tác dụng với dung dịch AgNO3 trong amoniac
Chọn D.
Bài 32.4 trang 49 SBT Hóa học 11: Có bao nhiêu ankin có cùng công thức phân tử C5H8?
A. 2 chất B. 3 chất C. 4 chất D. 5 chất
Lời giải:
Viết các đồng phân của C5H8
+ Đồng phân về mạch C ( mạch không phân nhánh và mạch nhánh)
+ Đồng phân về vị trí liên kết ba
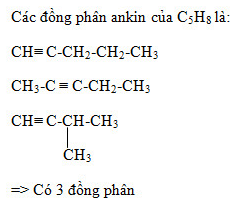
Chọn B.
Bài 32.5 trang 50 SBT Hóa học 11: Viết phương trình hoá học của phản ứng thực hiện các biến hoá dưới đây và ghi rõ điều kiện phản ứng (nếu có)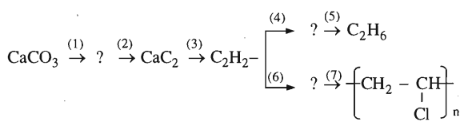
Lời giải:
(1)
(2)
(3)
(4)
(5)
(6)
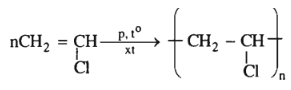
(7) 
Bài 32.6 trang 50 SBT Hóa học 11: Hỗn hợp khí A chứa hiđro và một ankin. Tỉ khối của A đối với hiđro là 4,8. Đun nóng hỗn hợp A có mặt chất xúc tác Ni thì phản ứng xảy ra với hiệu suất được coi là 100%, tạo ra hỗn hợp khí B không làm mất màu nước brom và có tỉ khối đối với Hiđro là 8.
Hãy xác định công thức phân tử và phần trăm về thể tích của từng chất trong hỗn hợp A và hỗn hợp B.
Phương pháp giải:
+) Giả sử trong 1 mol A có x mol CnH2n-2 và (1 – x) mol H2
+) Viết PTHH:
+) Theo ĐLBTKL: =
+) Biểu diễn theo x n
+) xác định công thức phân tử và phần trăm về thể tích của từng chất.
Lời giải:
Giả sử trong 1 mol A có x mol CnH2n-2 và (1 – x) mol H2. Khối lượng của 1 mol A là :
= (14n – 2)x + 2(1 – x) = 4,8.2 = 9,6 (g/mol) (1)
Khi đun nóng 1 mol A có mặt Ni, tất cả ankin đã biến hết thành ankan (vì B không tác dụng với nước brom) :
x mol 2x mol x mol
Số mol khí còn lại trong B là (1 – 2x) mol nhưng khối lượng hỗn hợp B vẫn bằng khối lượng hỗn hợp A tức là bằng 9,6 g. Khối lượng của 1 mol B:
= 8.2 = 16 (g/mol) x = 0,2.
Thay x = 0,2 vào (1), tìm được n = 3.
Hỗn hợp A : chiếm 20%, H2 chiếm 80%.
Hỗn hợp B : chiếm . 100% = 33%
Vậy H2 chiếm 67%.
Bài 32.7 trang 50 SBT Hóa học 11: Hỗn hợp khí A chứa C2H2 và H2. Tỉ khối của A đối với hiđro là 5. Dẫn 20,16 lít A đi nhanh qua chất xúc tác Ni nung nóng thì nó biến thành 10,8 lít hỗn hợp khí B. Dẫn hỗn hợp B đi từ từ qua bình đựng nước brom (có dư) cho phản ứng xảy ra hoàn toàn thì còn lại 7,39 lít hỗn hợp khí C. Các thể tích được đo ở đktc.
1. Tính phần trăm thể tích từng chất trong mỗi hỗn hợp A, B và C.
2. Khối lượng bình đựng nước brom tăng thêm bao nhiêu gam ?
Phương pháp giải:
1. +) A: C2H2 và H2
+) B: Khi A qua chất xúc tác Ni, xảy ra phản ứng cộng. C2H2 hợp hiđro có thể tạo thành C2H4 hoặc thành C2H6 hoặc thành cả 2 chất đó.
+) C: B đi qua nước brom dư, những hiđrocacbon không no đều bị giữ lại => C chỉ còn lại C2H6 và H2
+) Khai thác các dữ kiện của đề bài tìm số mol mỗi chất trong A, B, C => % thể tích của từng chất.
2. Khối lượng bình brom tăng = khối lượng hiđrocacbon không no bị giữ lại.
Lời giải:
1. Giả sử trong 20,16 lít A có x mol C2H2 và y mol H2.
ta có: x + y =
Giải hệ phương trình ta có x = 0,3 ; y = 0,6.
Thành phần hỗn hợp A : C2H2 chiếm . 100% = 33,33%
H2 chiếm 100% – 33,33% = 66,67%
Khi A qua chất xúc tác Ni, xảy ra phản ứng cộng. C2H2 hợp hiđro có thể tạo thành C2H4 hoặc thành C2H6 hoặc thành cả 2 chất đó :
Số mol khí trong hỗn hợp B : = 0,45 (mol).
Trong hỗn hợp A có 0,3 mol C2H2 thì trong hỗn hợp B cũng có 0,3 mol các hiđrocacbon.
Số mol H2 trong B là : 0,45 – 0,3 = 0,15 (mol).
Số mol H2 đã tham gia phản ứng : 0,6 – 0,15 = 0,45 (mol).
Khi B đi qua nước brom dư, những hiđrocacbon không no đều bị giữ lại hết (phản ứng hoàn toàn).
Vậy hỗn hợp C chỉ còn lại C2H6 và H2 với số mol tổng cộng là : = 0,33 (mol) ; trong đó số mol H2 là 0,15 mol, vậy số mol C2H6 là : 0,33 – 0,15 = 0,18 (mol).
Thành phần hỗn hợp C : C2H6 chiếm . 100% = 54,55% ; 0,330
H2 chiếm 100% – 55,45% = 45,45%.
Trong hỗn hợp B cũng phải có 0,18 mol C2H6. Để tạo ra 0,18 mol C2H6 cần 0,36 mol H2 tác dụng với C2H2. Vậy lượng H2 tác dụng với C2H2 để tạo ra C2H4 là : 0,45 – 0,36 = (mol).
Lượng C2H4 trong hỗn hợp B là (mol) và lượng C2H2 trong B là :
0,3 – 0,18 – = mol.
Thành phần hỗn hợp B :
C2H6 chiếm . 100% = 40% ;
C2H4 chiếm . 100% = 20% ;
C2H2 chiếm . 100% = 6,67% ;
H2 chiếm . 100% = 33,33%.
2. Khối lượng bình đựng nước brom tăng thêm :
= 3,3 (g).
Bài 32.8 trang 50 SBT Hóa học 11: Hỗn hợp khí A chứa hiđro, một anken và một ankin. Đốt cháy hoàn toàn 90 ml A thu được 120 ml CO2. Đun nóng 90 ml A có mặt chất xúc tác Ni thì sau phản ứng chỉ còn lại 40 ml một ankan duy nhất. Các thể tích đo ở cùng một điều kiện.
1. Xác định công thức phân tử và phần trăm thể tích từng chất trong hỗn hợp A.
2. Tính thể tích O2 vừa đủ để đốt cháy hoàn toàn 90 ml A.
Phương pháp giải:
+) Giả sử 90 ml A có x mol CnH2n, y mol CnH2n-2, z mol H2.
+) Viết các PTHH:
+) Khai thác dữ kiện đề bài, lập hệ pt => x, y, n, m
=> Trả lời yêu cầu bài toán
Lời giải:
1. Anken và ankin có thể biến thành cùng một ankan, vậy 2 chất đó có cùng số nguyên tử cacbon. Giả sử 90 ml A có x mol CnH2n, y mol CnH2n-2, z mol H2.
x + y + z = 90 (1)
x ml nx ml
y ml ny ml
Thể tích CO2 : n(x + y) = 120 (2)
x ml x ml x ml
y ml 2y ml y ml
H2 đã phản ứng : x + 2y = z (3)
Thể tích ankan : x + y = 40 (4)
Giải hệ phương trình tìm được x = 30, y = 10, z = 50, n = 3
Hỗn hợp A : C3H6 (33%) ; C3H4 (11%); H2 (56%).
2) Thể tích O2 là 200 ml.