Giải SBT Hóa học 11 Bài 46: Luyện tập: Anđehit, Xeton, Axit cacboxylic
Bài 46.1 trang 73 SBT Hóa học 11: Trong các nhận xét dưới đây, nhận xét nào không đúng ?
A. Tất cả các anđehit no, đơn chức, mạch hở đều có các đồng phân thuộc chức xeton và chức ancol.
B. Tất cả các xeton no đơn chức, mạch hở đều có các đồng phân thuộc chức anđehit và chức ancol.
C. Tất cả các ancol đơn chức, mạch hở có 1 liên kết đôi đều có các đồng phân thuộc chức anđehit và chức xeton.
D. Tất cả các ancol đơn chức, mach vòng no đều có các đồng phân thuộc chức anđehit và chức xeton.
Phương pháp giải:
Học sinh tự tổng hợp kiến thức của chương 9: Anđehit – xeton – axit cacboxylic để trả lời câu hỏi.
Lời giải:
Ví dụ: HCHO, CH3CHO không có đồng phân thuộc chức xeton và ancol.
=> Chọn A.
Bài 46.2 trang 73 SBT Hóa học 11: Chất X là một anđehit mạch hở chứa a nhóm chức anđehit và b liên kết 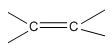 ở gốc hiđrocacbon. Công thức phân tử của chất X có dạng là ?
ở gốc hiđrocacbon. Công thức phân tử của chất X có dạng là ?
A.
B.
C.
D.
Lời giải:
anđehit mạch hở chứa a nhóm chức anđehit và b liên kết ở gốc hiđrocacbon có CTPT là:
=> Chọn D.
Bài 46.3 trang 74 SBT Hóa học 11: Axit ađipic có công thức là HOOC[CH2]4COOH. Tên thay thế của chất này là
A. axit butanđioic.
B. axit butan-1,4-đioic.
C. axit hexanđioic.
D. axit hexan-1,6-đioic.
Lời giải:
Axit ađipic có công thức là HOOC[CH2]4COOH có tên thay thế là: axit hexanđioic.
=> Chọn C
Bài 46.4 trang 74 SBT Hóa học 11: Có bao nhiêu axit cacboxylic thơm (có vòng benzen) ứng với công thức phân tử C8H8O2?
A. 5 chất B. 4 chất
C. 3 chất D. 2 chất
Lời giải:
Có 3 chất CH3 – C6H4 – COOH (-o, -m, -p) và 1 chất C6H5 – CH2 – COOH
=> Chọn B.
Bài 46.5 trang 74 SBT Hóa học 11: Độ linh động của nguyên tử H trong nhóm OH của các chất C2H5OH, C6H5OH, HCOOH và CH3COOH tăng dần theo trật tự nào ?
A. C2H5OH < C6H5OH < HCOOH < CH3COOH.
B. CH3COOH < HCOOH < C6H5OH < C2H5OH.
C. C2H5OH < C6H5OH < CH3COOH < HCOOH.
D. C6H5OH < C2H5OH < CH3COOH < HCOOH.
Phương pháp giải:
Xét khả năng đẩy, hút e của R(H) đính kèm phân tử.
Lời giải:
Đối với các chất có chức axit: CH3COOH có độ linh động kém hơn HCOOH vì CH3 đẩy e còn H không đẩy e.
Với các chất có dạng ROH sắp xếp theo thứ tự tăng dần: C2H5OH, C6H5OH do C2H5 đẩy e, C6H5 hút e.
=> Chọn C.
Bài 46.6 trang 74 SBT Hóa học 11: Trong các chất dưới đây, chất nào không có phản ứng hóa học với cả 3 chất: Na, NaOH, NaHCO3?
A. C2H5-OH B. C6H5-OH
C. C6H5-CHO D. C6H5-COOH
Lời giải:
Chất không có phản ứng hóa học với cả 3 chất: Na, NaOH, NaHCO3 là C6H5-CHO
=> Chọn C.
Bài 46.7 trang 74 SBT Hóa học 11: Ghép tên với công thức cấu tạo cho phù hợp.
|
Tên chất |
Công thức cấu tạo |
||
|
1 |
axit pentanoic |
A |
CH3-[CH2]2-COOH |
|
2 |
axit propanđioic |
B |
CH2=CH-COOH |
|
3 |
axit butanoic |
C |
CH3-COOH |
|
4 |
axit propenoic |
D |
CH3-[CH2]3-COOH |
|
5 |
axit metanoic |
E |
H-COOH |
|
6 |
axit etanoic |
F |
CH2(COOH)2 |
Lời giải:
1- D 2- F 3- A
4- B 5- E 6- C
Bài 46.8 trang 75 SBT Hóa học 11: Viết phương trình hóa học thực hiện các biến đổi dưới đây. Các chất hữu cơ được viết dưới dạng công thức cấu tạo và ghi tên.
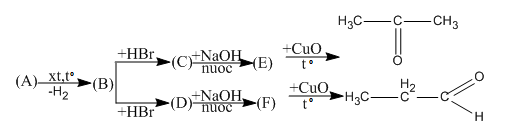
Lời giải:
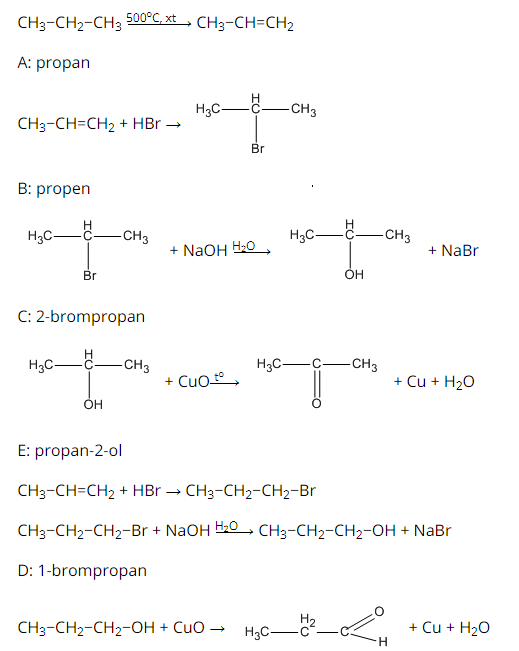
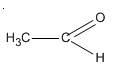
Bài 46.9 trang 75 SBT Hóa học 11: Anđehit axetic có thể khử được đồng (II) hiđroxit trong môi trường kiềm (natri hiđroxit) tạo ra kết tủa đồng(I) oxit có màu đỏ gạch.
Hãy viết phương trình hóa học biểu diễn phản ứng nói trên.
Bài 46.10 trang 75 SBT Hóa học 11: Chất hữu cơ A chỉ chứa cacbon, hiđro, oxi và chỉ có một loại nhóm chức.
Cho 0,9 g chất A tác dụng với lượng dư dung dịch trong amoniac, thu được 5,4 g Ag.
Cho 0,2 mol A tác dụng với có dư ( xúc tác Ni nhiệt độ ) ta được ancol B. Cho ancol B tác dụng với Na ( lấy dư ) thu được 4,48 lít (đktc).
Xác định công thức và tên chất A.
Phương pháp giải:
+) A chỉ chứa cacbon, hiđro, oxi và chỉ có một loại nhóm chức, A tác dụng với dung dịch AgNO3 trong amoniac tạo ra Ag => A chứa nhóm chức anđehit.
+) B có công thức R(CH2OH)x
+) Viết PTHH: R(CHO)2 + 4AgNO3 + 6NH3 + 2H2O R(COONH4)2 + 4NH4NO3 + 4Ag
+) Tính theo PTHH => Khối lượng mol của A => R.
Lời giải:
A tác dụng với dung dịch AgNO3 trong amoniac tạo ra Ag ; vậy A có chức anđehit.
0,2 mol anđehit kết hợp với hiđro phải tạo ra 0,2 mol ancol B có công thức R(CH2OH)x
R(CH2OH)x + xNa R(CH2ONa)x + H2
Theo phương trình 1 mol B tạo ra mol H2
Theo đầu bài 0,2 mol B tạo ra 0,2 mol H2
Vậy B là ancol hai chức và A là anđehit hai chức.
R(CHO)2 + 4AgNO3 + 6NH3 + 2H2O R(COONH4)2 + 4NH4NO3 + 4Ag
Số mol anđehit A = số mol Ag = = 0,0125 (mol)
Khối lượng 1 mol A = = 72(g).
R(CHO)2 = 72 R = 72 – 2.29 = 14. Vậy R là
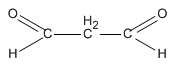 propanđia
propanđia
Bài 46.11 trang 75 SBT Hóa học 11: Chất hữu cơ X chỉ có chức anđehit. Biết 0,1 mol X có thể kết hợp với 4,48 lít (lấy ở đktc) khi có chất xúc tác Ni và nhiệt độ thích hợp.
Mặt khác, nếu cho 7 g X tác dụng với lượng dư dung dịch trong amoniac, thu được 27 g Ag.
Hãy xác định công thức phân tử, công thức cấu tạo và tên của chất X.
Phương pháp giải:
+) Theo đầu bài 0,1 mol anđehit X kết hợp được với 0,2 mol H2. Vậy X có thể là :
– Anđehit no hai chức CnH2n (CHO)2 hoặc
– Anđehit đơn chức có 1 liên kết đôi ở gốc CnH2n-1CHO.
+) Viết PTHH, tính toán đối với từng trường hợp trên kết luận CTPT của X.
Lời giải:
Theo đầu bài 0,1 mol anđehit X kết hợp được với 0,2 mol H2. Vậy X có thể là :
– Anđehit no hai chức CnH2n (CHO)2 hoặc
– Anđehit đơn chức có 1 liên kết đôi ở gốc CnH2n-1CHO.
1. Nếu X là CnH2n(CHO)2 thì :
Số mol X = số mol Ag = (mol).
Mx = =112 (g/mol)
= 112 (g/mol) hay 14n + 2.29 = 112 n = 3,86 (loại)
2. Nếu X là CnH2n-1CHO :
Số mol X = Số mol Ag = (mol).
Mx = = 56 (g/mol)
= 56 (g/mol) 14n + 28 = 56 n = 2
CTPT :
CTCT: CH2 = CH-CHO propenal.
Bài 46.12* trang 75 SBT Hóa học 11: Hỗn hợp M chứa ba hợp chất hữu cơ X, Y và Z. Hai chất X và Y kế tiếp nhau trong một dãy đồng đẳng ( ). Chất Z là đồng phân của chất Y.
Nếu làm bay hơi 3,2 g M thì thể tích hơi thu được đúng bằng thể tích của 1,68g khí nitơ ở cùng điều kiện.
Để đốt cháy hoàn toàn 16g M cần dùng vừa hết 23,52 lít (đktc). Sản phẩm cháy chỉ có và với số mol bằng nhau.
Nếu cho 48g M tác dụng với Na(lấy dư), thu được 1,68 lít (đktc).
Hãy xác địng công thức phân tử, công thức cấu tạo, tên và phần trăm về khối lượng của từng chất trong hỗn hợp M.
Phương pháp giải:
+) Đặt công thức chất X là CxHyOz thì chất Y là Cx+1Hy+2Oz. Chất Z là đồng phân của Y nên CTPT giống chất Y.
+) Giả sử trong 16 g hỗn hợp M có a mol chất X và b mol hai chất Y và Z
+) Viết PTHH:
+) Dựa vào dữ kiện đề bài và PTHH, lập hpt ẩn x, y, z, a, b.
+) Biện luận và giải hpt => CTPT của X, Y, Z.
+) Tính phần trăm về khối lượng của từng chất trong hỗn hợp M.
Lời giải:
Số mol 3 chất trong 3,20 g hỗn hợp M : = 0,06 (mol).
Số mol 3 chất trong 16 g M : = 0,3 (mol)
Khi đốt hỗn hợp M ta chỉ thu được CO2 và H2O.
Vậy, các chất trong hỗn hợp đó chỉ có thể chứa C, H và O.
Đặt công thức chất X là CxHyOz thì chất Y là Cx+1Hy+2Oz. Chất Z là đồng phân của Y nên công thức phân tử giống chất Y.
Giả sử trong 16 g hỗn hợp M có a mol chất X và b mol hai chất Y và Z :
Khi đốt 16 g M thì tổng khối lượng CO2 và H2O thu được bằng tổng khối lượng của M và O2 và bằng :
Mặt khác, số mol CO2 = số mol H2O = n :
44n + 18n = 49,6 n = 0,8
a mol xa mol a mol
b mol (x + 1)b mol b mol
Số mol CO2 là : xa + (x + 1)b = 0,8 (mol) (3)
Số mol H2O là : = 0,8 (mol)
do đó : ya + (y + 2)b = 1,6 (4)
Giải hệ phương trình :
Biến đổi (3) ta có x(a + b) + b = 0,8
Vì a + b = 0,3 nên b = 0,8 – 0,3x
Vì 0 < b < 0,3 nên 0 < 0,8 – 0,3x < 0,3 1,66 < x < 2,66
x nguyên x = 2 b = 0,8 – 0,3.2 = 0,2
a = 0,3 – 0,2 = 0,1
Thay giá trị của a và b vào (4), tìm được y = 4.
Thay giá trị của a, b, x và y vào (2), tìm được z = 1.
Vậy chất X có CTPT là C2H4O, hai chất Y và Z có cùng CTPT là C3H6O.
Chất X chỉ có thể có CTCT là 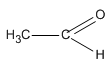 (etanal) vì chất CH2 = CH – OH không bền và chuyển ngay thành etanal.
(etanal) vì chất CH2 = CH – OH không bền và chuyển ngay thành etanal.
Chất Y là đồng đẳng của X nên CTCT là 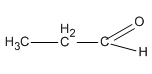 (propanal).
(propanal).
Hỗn hợp M có phản ứng với Na. Vậy, chất Z phải là ancol CH2 = CH – CH2 – OH (propenol) :
2CH2 = CH – CH2 – OH + 2Na 2CH2 = CH – CH2 – ONa + H2
Số mol Z trong 48 g M là : 2.số mol H2 = 2. =0,15 (mol).
Số mol Z trong 16 g M là : = 0,05 (mol)
Số mol Y trong 16 g M là : 0,2 – 0,05 = 0,15 (mol).
Thành phần khối lượng của hỗn hợp M :
Chất X chiếm : . 100% = 27,5%.
Chất Y chiếm : . 100% = 54,4%.
Chất Z chiếm : . 100% = 18,1%.
Bài 46.13 trang 76 SBT Hóa học 11: Viết phương trình hoá học thưc hiện các biến hoá dưới đây (mỗi mũi tên là một phản ứng) :
Lời giải:
(1)
(2)
(3)
(4)
(5)
(6)
(7)
(8)
(9)
(10) 2 2
(11)
(12)
(13)
(14)
(15)
Bài 46.14 trang 76 SBT Hóa học 11: Có 4 bình (không ghi nhãn), mỗi bình đựng 1 trong các dung dịch (dung môi là nước) : propan-1-ol, propanal, axit propanoic và axit propenoic.
Trình bày phương pháp hoá học để nhận biết các dung dịch đó. Viết phương trình hoá học của các phản ứng.
Phương pháp giải:
Gợi ý: dùng các hóa chất: AgNO3 trong amoniac, nước brom, CaCO3
Lời giải:
Cho 4 dung dịch thử phản ứng với dung dịch AgNO3 trong amoniac ; dung dịch nào có phản ứng tráng bạc là dung dịch propanal (3 dung dịch còn lại không phản ứng) :
C2H5CHO + 2AgNO3 + 3NH3 + H2O C2H5COONH4 + 2NH4NO3 + 2Ag
Thử 3 dung dịch còn lại với nước brom, chỉ có axit propenoic làm mất màu nước brom :
CH2 = CH – COOH + Br2 CH2Br – CHBr – COOH
Thử 2 dung dịch còn lại với CaCO3, chỉ có axit propanoic hoà tan CaCO3 tạo ra chất khí:
2C2H5COOH + CaCO3 (C2H5COO)2Ca + H2O + CO2
Dung dịch cuối cùng là dung dịch propan-1-ol.
Bài 46.15 trang 76 SBT Hóa học 11: Chất A là một axit cacboxylic no, mạch hở. Để trung hoà 50 g dung dịch A có nồng độ 5,2% cần dùng vừa đúng 50 ml dung dịch NaOH 1 M. Mặt khác, nếu đốt cháy hoàn toàn 15,6 g chất A, thu được 10,08 lít CO2 (đktc).
Hãy xác định công thức phân tử và công thức cấu tạo của A.
Vận dụng quy tắc đọc tên thay thế của axit, hãy cho biết tên của A.
Phương pháp giải:
+) A là CnH2n+2-x(COOH)x ; CTPT là Cn+xH2n+2O2x
+) Tính số mol NaOH trong 50 ml dung dịch 1 M
+) Các PTHH:
+) Dựa vào dữ kiện đề bài và PTHH lập hpt ẩn x, n
+) Giải hpt => CTPT A
+) Viết CTCT A và đọc tên
Lời giải:
A là axit no, mạch hở, chưa rõ là đơn chức hay đa chức ; vậy chất A là CnH2n+2-x(COOH)x ; CTPT là Cn+xH2n+2O2x
Khối lượng mol A là (14n + 44c + 2) gam. Khối lượng A trong 50 g dung dịch 5,2% là
Số mol NaOH trong 50 ml dung dịch 1 M là : = 0,05 (mol).
Theo phương trình : cứ (14n + 44x + 2) g A tác dụng với x mol NaOH
Theo đầu bài : cứ 2,6 g A tác dụng với 0,05 mol NaOH
Theo phương trình : Khi đốt (14n + 44x + 2) g A thu được (n + x) mol CO2
Theo đầu bài : Khi đốt 15,6 g A thu được =0,45 (mol) CO2
Từ (1) và (2), tìm được n = 1, x = 2 CTPT cùa A : C3H4O4
CTCT của A : HOOC – CH2 – COOH (Axit propanđi
Bài 46.16 trang 76 SBT Hóa học 11: Hỗn hợp M chứa ancol no A và axit cacboxylic đơn chức B, cả hai đều mạch hở. Tổng số mol 2 chất trong hỗn hợp M là 0,5 mol. Để đốt cháy hoàn toàn hỗn hợp M cần dùng vừa hết 30,24 lít O2. Sản phẩm cháy gồm có 23,4 g H2O và 26,88 lít CO2. Các thể tích đo ở đktc.
Hãy xác định công thức phân tử, công thức cấu tạo, tên gọi và phần trăm khối lượng từng chất trong hỗn hợp M, biết rằng chất B hơn chất A một nguyên tử cacbon.
Phương pháp giải:
+) Biện luận số nguyên tử cacbon trong A, B (A có 2 và B có 3 nguyên tử cacbon)=> CTTQ của A, B ( A là ancol no có 2 cacbon : C2H6-x(OH)x hay C2H6Ox B là axit đơn chức có 3 cacbon : C3HyO2.)
+) Viết các PTHH:
C2H6Ox + O2 2CO2 + 3H2O
C3HyO2+ O2 3CO2 + H2O
+) Gọi số mol A là a, số mol B là b, lập hpt ẩn a, b, x, y.
+) Giải hpt => CTPT của A, B.
+) Viết CTCT và gọi tên A, B.
Lời giải:
Khi đốt 0,5 mol hỗn hơp M, số mol CO2 thu đươc là : = 1,2 (mol).
Nếu đốt 1 mol hỗn hợp M, số mol CO2 thu được sẽ là 2,4 (mol).
Như vậy chất A và chất B có chứa trung bình 2,4 nguyên tử cacbon , chất A lại kém chất B 1 nguyên tử cacbon. Vậy, A có 2 và B có 3 nguyên tử cacbon.
A là ancol no có 2 cacbon : C2H6-x(OH)x hay C2H6Ox
B là axit đơn chức có 3 cacbon : C3HyO2.
Đặt số mol A là a, số mol B là b :
a + b = 0,5 (1)
C2H6Ox + O2 2CO2 + 3H2O
a mol mol 2a mol 3a mol
C3HyO2+ O2 3CO2 + H2O
b mol b mol 3b mol bmol
Số mol O2 là : (3,5 – 0,5x)a + (2 + 0,25y)b = = 1,35 (mol) (2)
Số mol CO2 là : 2a + 3b = 1,2 (mol) (3)
Số mol CO2 là : 3a + b = = 1,30 (mol) (4)
Giải hệ phương trình đại số tìm được : a = 0,3 ; b = 0,2 ; x = 2 ; y = 4.
Chất A : C2H6O2 hay etanđiol (hay etylenglicol) chiếm . 100% = 56,4% khối lượng M.
Chất B : C3H4O2 hay CH2 = CH – COOH, axit propenoic chiếm 43,64% khối lượng M.