Giải bài tập Hóa học lớp 11 Bài 45: Axit cacboxylic
Câu hỏi và bài tập ( trang 210 SGK Hóa học 11)
Bài 1 trang 210 SGK Hóa học 11: Thế nào là axit cacboxylic? Viết công thức cấu tạo, gọi tên các axit có công thức phân tử C4H8O2.
Lời giải:
– Axit cacboxylic: là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl (-COOH) liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hiđro.
– CTCT của các axit có CTPT C4H8O2 là:
CH3-CH2-CH2-COOH :axit butiric
CH3-CH(CH3)-COOH :axit isobutiric ( 2-metylpropanoic)
Bài 2 trang 210 SGK Hóa học 11: Từ công thức cấu tạo, hãy giải thích tại sao axit fomic có tính chất của một anđehit.
Lời giải:
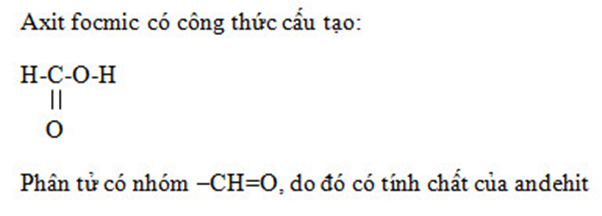
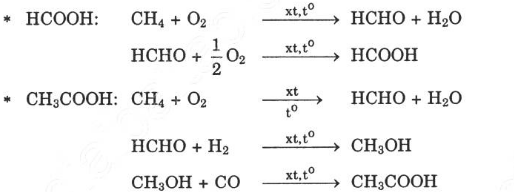
Bài 3 trang 210 SGK Hóa học 11: Từ metan và các chất vô cơ cần thiết khác có thể điều chế được axit fomic, axit axetic. Viết phương trình hóa học của các phản ứng xảy ra.
Lời giải:
Bài 4 trang 210 SGK Hóa học 11: Chất Y có công thức phân tử C4H8O2 tác dụng với NaOH tạo thành chất Z (C4H7O2Na). Vậy Y thuộc loại hợp chất nào sau đây?
A. Anđehit. B. Axit.
C. Ancol. D. Xeton.
Lời giải :
PTHH:
Đáp án B
Bài 5 trang 210 SGK Hóa học 11: Để trung hòa 150,0 gam dung dịch 7,40% của axit no, mạch hở, đơn chức X cần dùng 100,0 ml dung dịch NaOH 1,50M. Viết công thức cấu tạo và gọi tên của chất X.
Phương pháp giải:
Tính khối lượng axit
Gọi CTCT của axit no, mạch hở, đơn chức là CnH2n+1COOH ( n ≥ 0)
CnH2n+1COOH + NaOH → CnH2n+1COONa + H2O
nCnH2n+1COOH = nNaOH = ? (mol)
=> MCnH2n+1COOH = maxit : nCnH2n+1COOH = ?
=> CTPT và CTCT của axit
Lời giải:
; nNaOH = 0,1.1,5 = 0,15 (mol)
Gọi CTCT của axit no, mạch hở, đơn chức là CnH2n+1COOH ( n ≥ 0)
CnH2n+1COOH + NaOH → CnH2n+1COONa + H2O
nCnH2n+1COOH = nNaOH = 0,15 (mol)
=> MCnH2n+1COOH = maxit : nCnH2n+1COOH = 11,1 : 0,15 = 74 (g/mol)
=> 14n + 46 = 74
=> n =2
Vậy CTCT của axit là C2H5COOH : axit propionic
Bài 6 trang 210 SGK Hóa học 11: Trung hòa 16,60gam hỗn hợp gồm axit axetic và axit fomic bằng dung dịch natri hiđroxit thu được 23,20 gam hỗn hợp hai muối.
a) Viết phương trình hóa học của các phản ứng ở dạng phân tử và ion rút gọn.
b) Xác định thành phần phần trăm khối lượng của mỗi chất trong hỗn hợp trước và sau phản ứng.
Phương pháp giải :
a) PTHH dạng phân tử:
CH3COOH + NaOH → CH3COONa + H2O
HCOOH + NaOH → HCOONa + H2O
PTHH dạng ion rút gọn:
CH3COOH + OH– → CH3COO– + H2O
HCOOH + OH– → HCOO– + H2O
b) Đặt x là số mol CH3COOH ; y là số mol HCOOH
CH3COOH + NaOH → CH3COONa + H2O
x → x (mol)
HCOOH + NaOH → HCOONa + H2O
y → y (mol)
Ta có hệ phương trình:
=> phần trăm khối lượng của các chất trước và sau phản ứng
Lời giải :
a) PTHH dạng phân tử:
CH3COOH + NaOH → CH3COONa + H2O
HCOOH + NaOH → HCOONa + H2O
PTHH dạng ion rút gọn:
CH3COOH + OH– → CH3COO– + H2O
HCOOH + OH– → HCOO– + H2O
b) Đặt x là số mol CH3COOH ; y là số mol HCOOH
CH3COOH + NaOH → CH3COONa + H2O
x → x (mol)
HCOOH + NaOH → HCOONa + H2O
y → y (mol)
Ta có hệ phương trình:
Bài 7 trang 210 SGK Hóa học 11: Đun 12,0 gam axit axetic với một lượng dư ancol etylic ( có axit H2SO4 đặc làm xúc tác ). Đến khi dừng thí nghiệm thu được 12,3 gam este.
a) Viết phương trình hóa học của phản ứng.
b) Tính phần trăm khối lượng của axit đã tham gia phản ứng este hóa.
Phương pháp giải :
a) PTHH: CH3COOH + C2H5OH <=> CH3COOC2H5 + H2O
b)
Đổi số mol CH3COOC2H5 =?
Tính được nCH3COOH pư = nCH3COOC2H5 =?
Lời giải :
a) nCH3COOH bđ = 12: 60 = 0,2 (mol) ; số mol CH3COOC2H5 = 12,3 : 88 = 0,14 (mol)
PTHH: CH3COOH + C2H5OH <=> CH3COOC2H5 + H2O
b) nCH3COOH pư = nCH3COOC2H5 = 0,14 (mol)
Lý thuyết Bài 45: axit cacboxylic
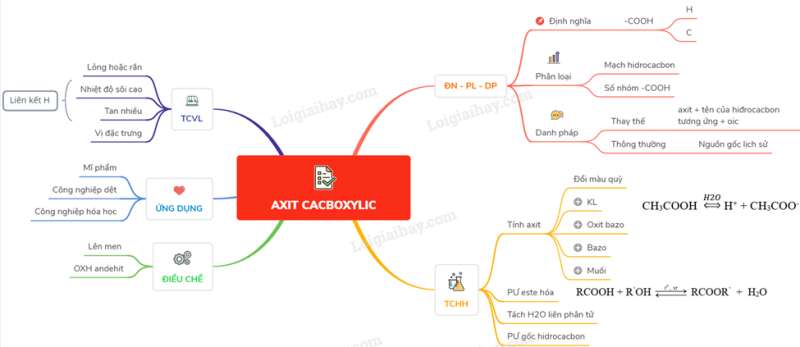
I. ĐỊNH NGHĨA, PHÂN LOẠI, DANH PHÁP
1. Định nghĩa
Là những hợp chất hữu cơ mà phân tử có nhóm cacboxyl – COOH liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hiđro.
2. Phân loại
– Dựa vào mạch hiđrocacbon: axit no, không no, thơm
– Dựa vào số nhóm cacboxyl: đơn chức và đa chức
3. Danh pháp
– Danh pháp thay thế: axit + tên của hiđrocacbon tương ứng + oic
– Danh pháp thông thường : có nguồn gốc lịch sử, tùy thuộc vào từng axit
II. TÍNH CHẤT VẬT LÍ
– Ở điều kiện thường tất cả các axit cacboxylic đều là chất lỏng hoặc chất rắn. Nhiệt độ sôi cao hơn ancol, anđehit, xeton có cùng số nguyên tử cacbon.
– Axit fomic và axit axetic tan vô hạn trong nước và độ tan của các axit giảm dần theo chiều tăng của phân tử khối
– Mỗi axit đều có vị riêng đặc trưng
– Axit cacboxylic cũng tạo liên kết hiđro với nước.
III. TÍNH CHẤT HÓA HỌC
1. Tính axit và ảnh hưởng của nhóm thế
– Trong dung dịch, axit cacboxylic phân li thuận nghịch:
![]()
– Dung dịch axit cacboxylic làm quỳ tím chuyển sang màu đỏ.
– Tác dụng với bazơ, oxit bazơ tạo thành muối và nước
– Tác dụng với muối
– Tác dụng với kim loại trước hiđro:
2. Phản ứng tạo thành dẫn xuất axit
a) Phản ứng thế nhóm –OH: Phản ứng giữa axit và ancol được gọi là phản ứng este hóa.
Chiều thuận là phản ứng este hoá, chiều nghịch là phản ứng thuỷ phân este.
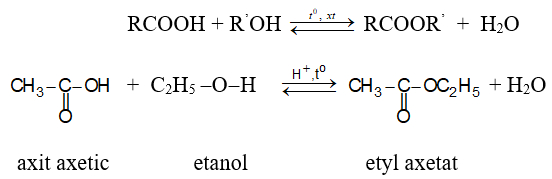
b) Phản ứng tách nước liên phân tử
3. Phản ứng ở gốc hidrocacbon
a) Phản ứng thế ở gốc no
Khi dùng photpho (P) làm xúc tác, Cl chỉ thế cho H ở cacbon bên cạnh nhóm cacboxyl.
![]()
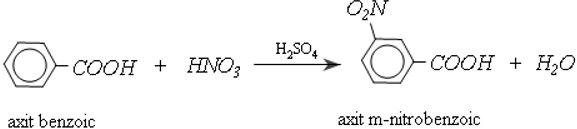
b) Phản ứng thế ở gốc thơm
Nhóm cacboxyl ở vòng benzen định hường cho phản ứng thế tiếp theo vào vị trí meta và làm cho phản ứng khó khăn hơn so với thế vào benzen:

c) Phản ứng cộng vào gốc không no
Axit không no tham gia phản ứng cộng H2, Br2, Cl2, … như hiđrocacbon không no.
IV. ĐIỀU CHẾ
Axit CH3 – COOH được sản xuất theo nhiều phương pháp như lên men giấm hay oxi hóa anđehit axetic,..
V. ỨNG DỤNG
Có nhiều ứng dụng trong các lĩnh vực như: làm nguyên liệu cho công nghiệp mĩ phẩm, công nghiệp dệt, công nghiệp hóa học,…
Sơ đồ tư duy: Axit cacboxylic