Giải SBT Hóa học 11 Bài 45: Axit Cacboxylic
Bài 45.1 trang 71 SBT Hóa học 11: Chất
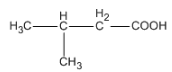 có tên là ?
có tên là ?
A. axit 2-metylpropanoic.
B. axit 2-metylbutanoic.
C. axit 3-metylbuta-1-oic.
D. axit 3-metylbutanoic.
Lời giải:
Chất trên có tên là: axit 3-metylbutanoic.
=> Chọn D.
Bài 45.2 trang 71 SBT Hóa học 11: Axit propionic có công thức cấu tạo :
A. CH3-CH2-CH2-COOH.
B. CH3-CH2-COOH.
C. CH3-COOH.
D. CH3-[CH2]3-COOH.
Lời giải:
Axit propionic: CH3-CH2-COOH.
=> Chọn B.
Bài 45.3 trang 71 SBT Hóa học 11: Axit propenoic có công thức cấu tạo là
A. CH3-CH2-CH2-COOH.
B. CH3-CH=CH-COOH.
C. CH2 = CH – COOH.
D. CH2 = CH – CH2 – COOH.
Lời giải:
Axit propenoic: CH2 = CH – COOH
=> Chọn C.
Bài 45.4 trang 71 SBT Hóa học 11: Bốn chất sau đây đều có phân tử khối là 60. Chất nào có nhiệt độ sôi cao nhất ?
A. H-COO-CH3.
B. HO-CH2-CHO.
C. CH3-COOH.
D. CH3-CH2-CH2-OH.
Lời giải:
Axit cacbonxylic có nhiệt độ sôi cao hơn ancol, anđehit, xeton có cùng số nguyên tử cacbon.
=> Chọn C.
Bài 45.5 trang 71 SBT Hóa học 11: Trong 4 chất dưới đây, chất nào dễ tan trong nước nhất ?
A. CH3-CH2-COO-CH3.
B. CH3-COO-CH2-CH3.
C. CH3-CH2-CH2-COOH.
D. CH3-CH2-CH2-CH2-COỌH.
Lời giải:
độ tan của các axit giảm dần theo chiều tăng của phân tử khối
=> Chọn C.
Bài 45.6 trang 71 SBT Hóa học 11: Trong 4 chất dưới đây, chất nào phản ứng được với cả 3 chất : Na, NaOH và NaHCO3 ?
A. C6H5-OH.
B. HO-C6H4-OH.
C. H-COO-C6H5.
D. C6H5-COOH.
Phương pháp giải:
Gợi ý: chất trên là chất có nhóm chức -COOH
Lời giải:
Chất phản ứng được với cả 3 chất : Na, NaOH và NaHCO3 là C6H5-COOH.
=> Chọn D.
Bài 45.7 trang 71 SBT Hóa học 11: Có bao nhiêu axit cacboxylic có cùng công thức phân thức C5H10O2?
A. 2 chất B. 3 chất
C. 4 chất D. 5 chất
Phương pháp giải:
Viết các đồng phân axit cacboxylic của C5H10O2
Lời giải:
Các axit cacboxylic C5H10O2 phải có dạng C4H9-COOH. Có 4 gốc -C4H9 vì vậy có 4 axit.
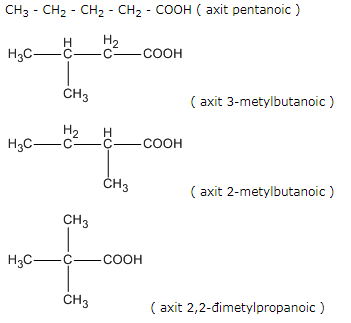
=> Chọn C.
Bài 45.8 trang 71 SBT Hóa học 11: Dãy nào sau đây gồm các chất đều có thể điều chế trực tiếp ra axit axetic?
A. C2H5OH, CH3, H-COO-CH3
B. C2H2, CH3CHO, CH3-COO-C2H5
C. CH3COONa, H-CHO, CH3(CH2)2CH3
D. C2H5OH, CH3CHO, CH3OH
Lời giải:
axit CH3 – COOH được sản xuất theo nhiều phương pháp như lên men giấm hay oxi hóa andehit axetic,…
=> Chọn D.
Bài 45.9 trang 72 SBT Hóa học 11: Cho 1,08 g axit cacboxylic đơn chức tác dụng vừa đủ với dung dịch KOH rồi cô cạn dung dịch, thu được 1,65g muối khan. Axit đó là
A. H-COOH
B. CH3-COOH
C. C2H3-COOH
D. C3H5-COOH
Phương pháp giải:
) Viết PTHH: RCOOH + KOH → RCOOK + H2O
+) Sử dụng phương pháp tăng giảm khối lượng=> R => Công thức của axit.
Lời giải:
Axit cacboxylic đơn chức tác dụng với KOH:
RCOOH + KOH → RCOOK + H2O
1 mol 1 mol
Cứ 1 mol RCOOH biến thành 1 mol RCOOK, khối lượng tăng: 39 – 1 = 38 (g).
Khi 1,08 (g) RCOOH biến thành 1,65 (g) RCOOK, khối lượng tăng: 1,65 – 1,08 = 0,57 (g).
Vậy số mol RCOOH = 0,57: 38 = 0,015 (mol).
Và khối lượng mol RCOOH = 1,08: 0,015 = 72 → phù hợp với C2H3COOH.
=> Chọn C.
Bài 45.10 trang 72 SBT Hóa học 11: Người ta có thể điều chế axit axetic xuất phát từ một trong các hiđrocacbon dưới đây (cùng với các chất vô cơ cần thiết) :
1. metan ;
2. etilen ;
3. axetilen ;
4. butan.
Hãy viết phương trình hoá học của phản ứng xảy ra trong các quá trình đó, có ghi rõ điểu kiện phản ứng.
Lời giải:
1. Từ
2. Từ
3. Từ : Hai phản ứng cuối ở phần 1.
4. Từ :
Bài 45.11 trang 72 SBT Hóa học 11: Dung dịch axit fomic 0,092% có khối lượng riêng xấp xỉ 1 g/ml. Trong dung dịch đó, chỉ có 5,0% số phân tử axit fomic phân li thành ion.
Hãy tính pH của dung dịch đó.
Phương pháp giải:
+) Tính số mol axit fomic ban đầu.
+) Tính số mol axit fomic phân li thành ion.
+) Viết PTHH => số mol H+
+) Tính pH theo công thức:
Lời giải:
Khối lượng của 1 lít (1000 ml) dung dịch axit fomic 0,092% là 1000 g. trong đó khối lượng của axit fomic là :
và số mol axit fomic là : = 0,02 (mol).
Số mol axit fomic phân li thành ion là : = 0,001 (mol).
0,001 mol 0,001 mol
Nồng độ [H+] = 0,001 mol/l = mol/l. Vậy pH = 3.
Bài 45.12 trang 72 SBT Hóa học 11: Hoàn thành các phương trình hoá học dưới đây (nếu phản ứng có xảy ra) :
1.
2.
3.
4.
5.
6.
7.
8.
Lời giải:
1.
2. Không có phản ứng
3. Không có phản ứng
4.
5. Không có phản ứng
6.
7.
8. Không có phản ứng
Bài 45.13 trang 72 SBT Hóa học 11: Chất A là một axit no, đơn chức, mạch hở. Để đốt cháy hoàn toàn 2,55 gam A phải dùng vừa hết 3,64 lít O2 (đktc). Hãy xác định công thức phân tử, công thức cấu tạo và tên của chất A.
Lời giải:
Theo phương trình, (14n + 32) gam axit tác dụng với mol O2
Theo đầu bài, 2,55 gam axit tác dụng với mol O2
Công thức phân tử của axit là C5H10O2
Bài 45.14 trang 73 SBT Hóa học 11: Chất A là một axit cacboxylic đơn chức, dẫn xuất của anken. Khi đốt cháy hoàn toàn 0,9 g A, người ta thấy trong sản phẩm tạo thành, khối lượng CO2 lớn hơn khối lượng H2O 1,2 g.
Hãy xác định công thức phân tử, công thức cấu tạo của A. Vận dụng cách đọc tên thay thế của các axit, hãy cho biết tên của chất A.
Phương pháp giải:
+) Viết PTHH:
+) Dựa vào dữ kiện đề bài kết hợp với PTHH, lập phương trình ẩn n.
+) Giải pt => n => CTPT và CTCT của axit.
Lời giải:
Theo phương trình : Nếu đốt (14n + 30) g A, khối lượng CO2 nhiều hơn khối lượng H2O (26n + 1,08) g.
Theo đầu bài : Nếu đốt 0,9 g A, khối lượng CO2 nhiều hơn khối lượng H2O là 1,2 g.
Vậy
CTPT của axit là C3H4O
CTCT : CH2 = CH – COOH Axit propenoic.
Bài 45.15 trang 73 SBT Hóa học 11: Dung dịch X có chứa đồng thời hai axit cacboxylic no, đơn chức, mạch hở, kế tiếp nhau trong dãy đồng đẳng.
Lấy 80 ml dung dịch X đem chia làm hai phần như nhau. Trung hoà phần (1) bằng dung dịch NaOH rồi cô cạn thu được 4,26 g hỗn hợp muối khan. Trung hoà phần (2) bằng dung dịch Ba(OH)2 rồi cô cạn, thu được 6,8 g hỗn hợp muối khan.
Hãy xác định công thức phân tử và nồng độ mol của từng axit trong dung dịch X.
Phương pháp giải
+) CT chung 2 axit là
+) Viết các PTHH:
2
+) Dựa vào PTHH lập hpt ẩn x và . Giải hpt => CTPT 2 axit.
+) Gọi số mol mỗi axit lần lượt là a, b (mol)
+) Lập hpt ẩn a, b. Giải hpt => nồng độ mol của từng axit trong dung dịch X.
Lời giải:
Đặt công thức chung của 2 axit là
Phần 1 :
x mol x mol
(14 + 68)x = 4,26 (1)
Phần 2 :
2
x mol mol
(28 + 227) = 6,08 (2)
Từ (1) và (2) tìm được = 2,75; x = 0,04.
Axit thứ nhất là C2H5COOH (C3H8O2) có số mol là a mol.
Axit thứ hai là C3H7COOH (C4H8O2) có số mol là b mol.
CM của C2H5COOH là: = 0,25 (mol/l).
CM của C3H7COOH là: = 0,75 (mol/l).
Bài 45.16 trang 73 SBT Hóa học 11: Hỗn hợp M gồm axit cacboxylic no, đơn chức, mạch hở A và anol no đơn chức mạch hở B. Hai chất A và B có cùng số nguyên tử cacbon.
Lấy 25,8 g M đem chia làm 2 phần đều nhau. Cho phần (1) tác dụng hết với natri thu được 2,80 lít H2. Để đốt cháy hoàn toàn phần (2) cần dùng vừa hết 14,56 lít . Các thể tích tính ở đktc.
Xác định công thức phân tử, công thức cấu tạo, tên và phần trăm về khối lượng của từng chất trong hỗn hợp M.
Phương pháp giải:
+) Chất A có CTPT là CnH2nO2, CTCT là Cn-1H2n-1COOH
Chất B có CTPT là CnH2n+2O, CTCT là CnH2n+1OH.
+) Viết các PTHH:
P1:
P2:
+) Dựa vào dữ kiện đề bài và PTHH, lập hpt ẩn để tìm n và số mol mỗi axit.
+) Tính phần trăm về khối lượng của từng chất trong hỗn hợp M
Lời giải:
Chất A có CTPT là CnH2nO2, CTCT là Cn-1H2n-1COOH
Chất B có CTPT là CnH2n+2O, CTCT là CnH2n+1OH.
Phần (1) :
x mol mol
y mol mol
Phần (2) :
x mol x mol
y mol y mol
Khối lượng mỗi phần : (14n + 32)x + (14n + 18)y = = 12,9 (3)
Từ hệ các phương trình (1), (2), (3), tìm được n = 2; x = 0,1; y = 0,15.
Chất A : hay (axit axetic) chiếm : .100% = 46,5% khối lượng hỗn hợp.
Chất B : C2H6O hay CH3-CH2-OH (ancol etylic) chiếm : 100% – 46,5% = 53,5% khối lượng hỗn hợp.